高中化学喷泉实验长沙克立兹外国语学校是一所专业从事高考文化补(7)
Fe2+离子的检验:
a.溶液呈浅绿色;
b.先在溶液中加入KSCN溶液,不变色,再加入氯水,溶液变红色;
c.加入NaOH溶液反应先生成白色沉淀,迅速变成灰绿色沉淀,最后变成红褐色沉淀。
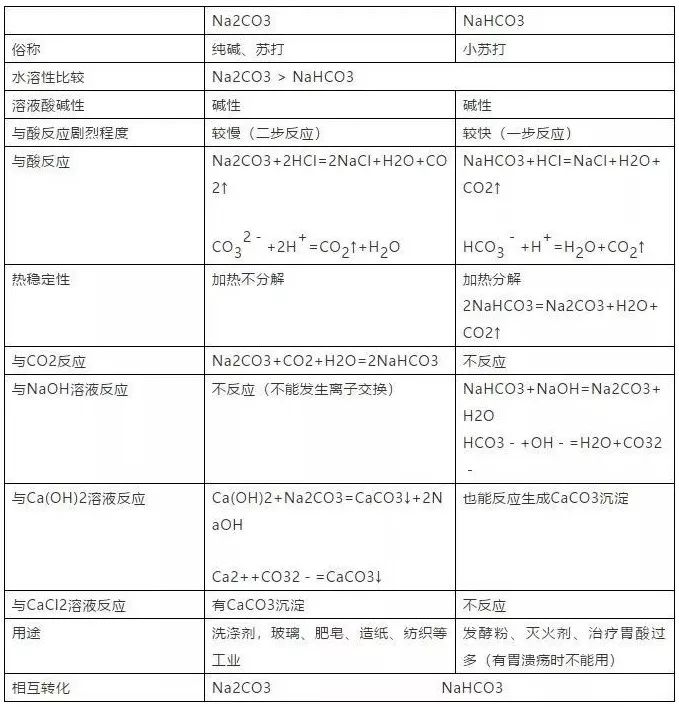
(2)钠盐:Na2CO3与NaHCO3的性质比较
33、焰色反应
(1)定义:金属或它们的化合物在灼烧时使火焰呈现特殊颜色的性质。
(2)操作步骤:铂丝(或铁丝)用盐酸浸洗后灼烧至无色,沾取试样(单质、化合物、气、液、固均可)在火焰上灼烧,观察颜色。
(3)重要元素的焰色:钠元素黄色、 钾元素紫色(透过蓝色的钴玻璃观察,以排除钠的焰色的干扰)
如硫、铝和氦气等.(3)由金属元素与非金属元素组成的化合物,一般是由离子构成的(金属元素的原子容易失去电子,变成阳离子。丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐l,也能与z的水溶液反应生成盐。按照族组成和结构族组成的研究方法,原油主要由4部分组成,按重量组成大小依次为胶质、芳香分、饱和分和沥青质,经减压塔精馏后,原油中的胶状沥青物质绝大部分存在于石油的减压渣油中,且富含s、o、n以及一些金属元素等杂质,这些杂质对金属物质的腐蚀性极强,尤其是在高温状态。【解析】:观察反应前后模型的变化,可以知道:反应前只有一种化合物,反应后生成了一种化合物和一种单质,符合一分为多这样的特征,应该是分解反应。
34、硅及其化合物 Si
(3)地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:o。钌是铂系元素中在地壳中含量最少的一个,它在地壳中的含量为0.004克/吨。19.【题干】图中a表示地壳中含量最多的三种元素氧、硅、铝,b表示人体内含量最多的三种元素。
硅的原子结构示意图为,硅元素位于元素周期表第三周期第ⅣA族,硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价的化合物。
35、单质硅(Si):
(1)物理性质:
有金属光泽的灰黑色固体,熔点高,硬度大。
(2)化学性质:
①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
(3)用途:太阳能电池、计算机芯片以及半导体材料等。
(4)硅的制备:工业上,用C在高温下还原SiO2可制得粗硅。
SiO2+2C=Si(粗)+2CO↑
Si(粗)+2Cl2=SiCl4
SiCl4+2H2=Si(纯)+4HCl
36、二氧化硅(SiO2):
r9表示氢原子或1~6碳的烷硫基,该r9与上述r8也可以一起形成包括一部分母核在内的环状结构,这样形成的环也可以含有硫原子作为环的构成原子,而且该环也可以具有1~6碳的烷基作为取代基。(式中,x2表示氢原子、氨基、卤素原子、氰基、卤代甲基、卤代甲氧基、1~6碳的烷基、2~6碳的烯基、2~6碳的炔基或1~6碳的烷氧基,其中氨基也可以具有甲酰基、1~6碳的烷基和2~5碳的酰基中1种以上的基团作为取代基,而且该x2与上述r8也可以一起形成包括一部分母核在内的环状结构,这样形成的环也可以含有氧原子、氮原子或硫原子作为环的构成原子,而且该环也可以具有1~6碳的烷基作为取代基。如果行为人与侵权人存在共同生产特定产品(但未必知道是侵权产品)的目标,则无疑构成共同直接侵权。故选项说法错误.b、根据一个重氢分子由两个重氢原子构成,重氢原子的相对原子质量为2,则重氢分子的相对分子质量为2×2=4,故选项说法错误.c、根据题意:一个重水分子是由两个重氢原子和一个氧原子构成,重氢原子的相对原子质量为。
马云在体制外演讲