高中化学喷泉实验长沙克立兹外国语学校是一所专业从事高考文化补(15)

高中化学必修二
50、原子核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;
③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
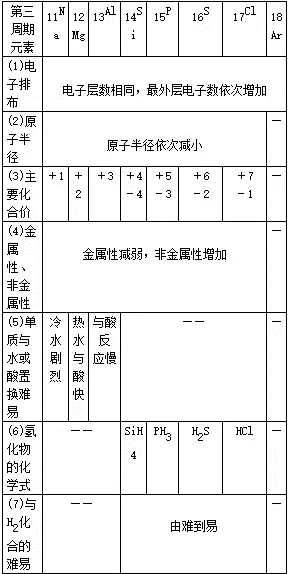
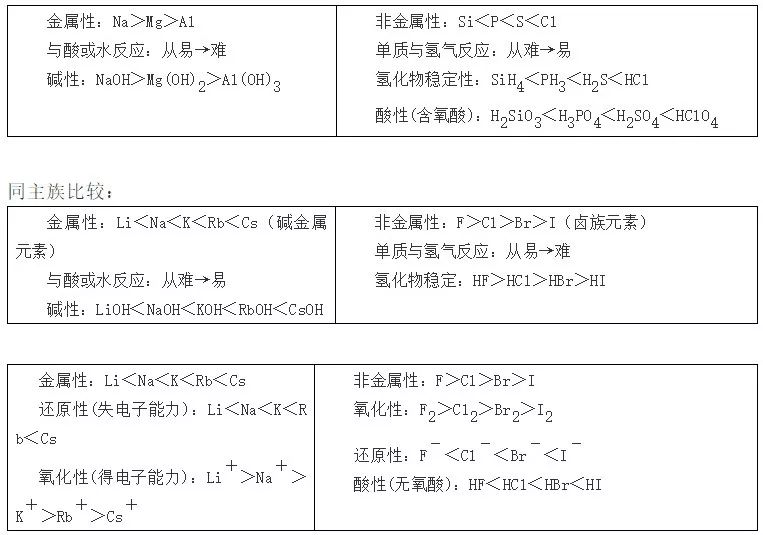
51、同周期元素性质递变规律
第二节 元素周期律一、选择题1.下列叙述正确的是 a.同周期元素的原子半径以a族的为最大 b.周期表中a族的元素称为碱金属元素 c.a、a族元素的原子,其半径越大越容易失电子 d.所有主族元素的最高正价数都和它的族序数相等...c.12 6c13 6c、14 6c是碳的三种核素 d.16 8o17 8o、18 8o含有相同的中子数4. a、b、c、d、e是同一周期的五种主族元素,a和b的最高价氧化物对应的水化物均呈碱性,且碱性b>a,c和d的气态氢化物的稳定性c>d。钠,钾的为同族碱金属元素且性质相近,外层只有一个电子,他们的晶格空隙较 大,产生了互相渗透的现象,合金的熔点比构成它的金属钠和金属钾都要低,在以下两种配 比的钾钠合金中实验测得其熔点最低。d.所有周期的元素都是从碱金属元素开始,以稀有气体元素结束。46 元素周期表上的第一主族的元素全部都是碱金属元素。
第ⅦA族卤族元素:F Cl Br IAt(F是非金属性最强的元素,位于周期表右上方)
52、判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu。
根据课标对“物质分类”、“胶体”、“离子反应”“氧化还原反应”知识内容的目标要求,通过比较三种版本整合初中酸、碱、盐、单质、氧化物相互反应有关内容而引出物质的分类的不同特点,再通过比较三种版本用物质变化及其分类这条主线将四项知识串联起来的共同特点,教学过程设计应始终围绕这些特点,运用分类的思想,以学生已有知识经验为基础,有效地进行初高中教学内容的衔接。16.讲吧下列能推断出x一定是氧化物的是a.x与酸或碱反应(氧化物,单质,氢气,金属,双水解,排除法,碳酸铝)。
同周期比较:
比较粒子(包括原子、离子)半径的方法:
(1)先比较电子层数,电子层数多的半径大。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小。
53、离子键与共价键的比较
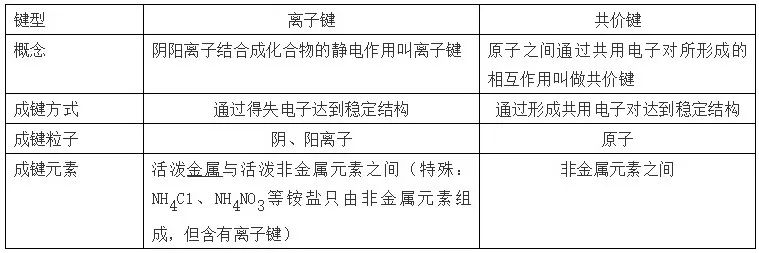
离子化合物:由离子键构成的化合物叫做离子化合物。(一定有离子键,可能有共价键)
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。(只有共价键)

54、电子式:
用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:
(1)电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷。
(2)[ ](方括号):离子键形成的物质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号。
55、常见的放热反应
①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸反应制取氢气。
④大多数化合反应(特殊:是吸热反应)。

56、常见的吸热反应:
① 以C、H2、CO为还原剂的氧化还原反应如:
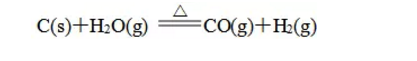
吸热反应实例:c+co2 2co h2+cuo cu+h2o ba(oh)2��8h2o+2nh4cl bacl2+8nh3↑+10h2o等。a. ba(oh)2 b. ba(no3)2 c. na2s d. bacl2。
②大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
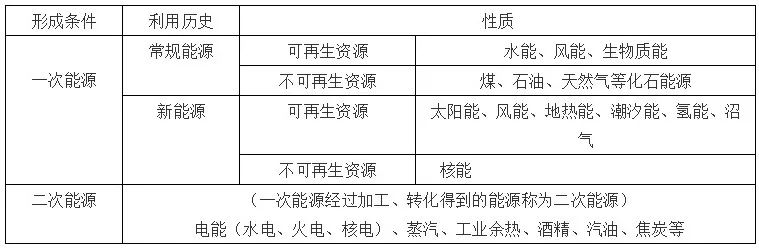
57、能源的分类: