高中化学喷泉实验长沙克立兹外国语学校是一所专业从事高考文化补(14)
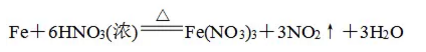
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示。氧离子导电是由稳定氧化锆的氧离子通过氧空位的迁移而实现的,在电场作用下,晶格中的氧离子空位 或氧离子 发生定向的移动,氧离子 7上海大学硕士学位论文 由一个位置跳跃到另一位置时,必定要越过一定的势垒,即产生离子电导的活化能励。问题一:1.由于反应到最后加入kscn溶液,溶液不变红色,所以理论上是不存在三价铁离子,只有二价铜离子和二价铁离子,这也说明全部的稀硝酸也刚好反应完毕(因为如果还存在硝酸,那么其氧化性会把二价铁离子氧化成三价铁离子)。复分解反应的条件——两种化合物互相交换成分,产生沉淀、气体或水,复分解反应即可发生。
48、氨气(NH3)
(1)氨气的物理性质:无色气体,有刺激性气味、比空气轻,易液化,极易溶于水,1体积水可以溶解700体积的氨气(可做红色喷泉实验)。浓氨水易挥发出氨气。
(2)氨气的化学性质:
a. 溶于水溶液呈弱碱性:
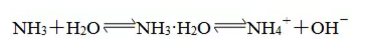
生成的一水合氨NH3·H2O是一种弱碱,很不稳定,受热会分解:
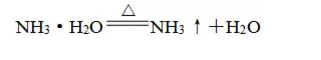
《环境化学》 第三章 水环境化学一、水的特征与分布 1、水分子特性h o h h h h hhf -83 20o o(1)高熔点(melting point)和高沸点(boiling point) a、偶极-偶极作用 b、氢键 比较项目 mp(℃) bp(℃) ch4 -192 -164 nh3 -78 -33氢键 h2o 0 100o(2)特殊的密度 ρ气<ρ固<ρ液 ,4℃时ρh2o最大。2、看清鸟啊——就是说氨水浓度从最小变到最大,密度变化仅为0.1170克立方厘米,而且密度和浓度,还不是线性关系。cu+(aq)+cl﹣(aq),加入浓氨水,浓氨水与cu+反应生成cu(nh3)2+,cu+浓度减小,平衡正向移动,促进cucl溶解,。
氨水中的微粒:H2O、NH3、NH3·H2O、NH4+、OH—、H+(极少量,水微弱电离出来)。
b. 氨气可以与酸反应生成盐:
①NH3+HCl=NH4Cl
②NH3+HNO3=NH4NO3
③ 2NH3+H2SO4=(NH4)2SO4
因NH3溶于水呈碱性,所以可以用湿润的红色石蕊试纸检验氨气的存在,因浓盐酸有挥发性,所以也可以用蘸有浓盐酸的玻璃棒靠近集气瓶口,如果有大量白烟生成,可以证明有NH3存在。
(3)氨气的实验室制法:
①原理:铵盐与碱共热产生氨气
②装置特点:固+固气体,与制O2相同。
③收集:向下排空气法。
④验满:
a. 湿润的红色石蕊试纸(NH3是唯一能使湿润的红色石蕊试纸变蓝的气体)
b. 蘸浓盐酸的玻璃棒(产生白烟)
⑤干燥:用碱石灰(NaOH与CaO的混合物)或生石灰在干燥管或U型管中干燥。不能用CaCl2、P2O5、浓硫酸作干燥剂,因为NH3能与CaCl2反应生成CaCl2·8NH3。P2O5、浓硫酸均能与NH3反应,生成相应的盐。所以NH3通常用碱石灰干燥。
关键原因就在于乙组白鼠呼吸的空气中的阴离子已被棉花完全吸收所致。同时,随着压力的减小,溶液沸点降低,其粘度亦随之增大,常使对流传热系数减小,从而也使总传热系数减小。
(4)氨气的用途:液氨易挥发,汽化过程中会吸收热量,使得周围环境温度降低,因此,液氨可以作制冷剂。
49、铵盐
铵盐均易溶于水,且都为白色晶体(很多化肥都是铵盐)。
(1)受热易分解,放出氨气:

(2)干燥的铵盐能与碱固体混合加热反应生成氨气,利用这个性质可以制备氨气:
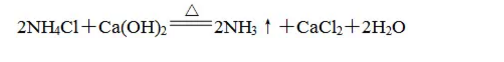
(3)NH4+的检验:样品加碱混合加热,放出的气体能使湿的红色石蕊试纸变蓝,则证明该物质会有NH4+。
中国军队尤其海军必须始终头顶国耻心记仇恨