药品不良反应制度 MAH制度:一场医药圈引发的“蝴蝶效应”(2)
而自MAH制度试行以来,其取得的成绩也显而易见。在2017年6月份于上海召开的“药品上市许可持有人制度高峰论坛”中,CFDA药品化妆品注册管理司副司长杨胜透露了一组数据:截至2017年5月31日,根据试点方案申报受理的注册申请共有381例。

值得注意的是,在这381例注册申请中,除了常规的以生产企业为主体的申请仍占多数之外,也已经出现了大量以研发机构为主体的申报案例,共计有142例,占比为37%。除此之外,还出现了一例以科研人员为主体的申报案例,这在之前是绝无仅有的。
与此同时,各试点城市也纷纷加快当地MAH制度的推广进程,一些成果也已经开始显现出来。从发布细则的速度来看,毫无疑问是上海最快,“我们不光发布了实施方案,还同时出台了办事指南、相关政策解读,时间我记得特别清楚,2017年8月3日,我们整理出文件后领导一批我们就马上发布出来了”。上海市食药监局副局长陈尧水此前在“药品上市许可持有人制度高峰论坛”如此表示。
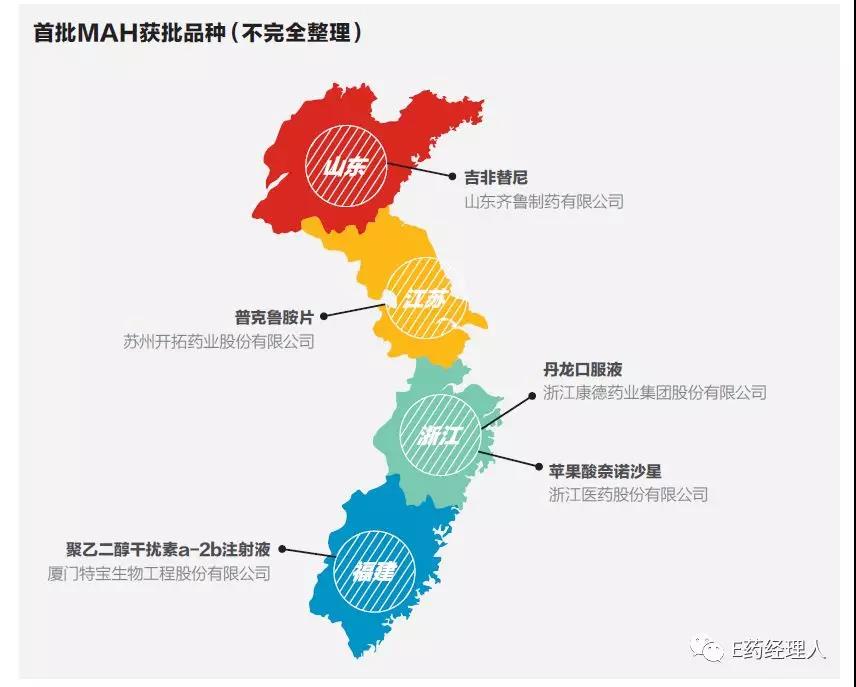
而山东则在行动上占据了先机。2016年12月23日,山东省齐鲁制药研发的抗肿瘤药吉非替尼及片剂经总局批准取得持有人文号,成为国内首个药品上市许可持有人制度试点品种。而随后,2017年3月27日,浙江医药新昌制药厂的苹果酸奈诺沙星原料药及胶囊剂经CFDA批准,成为了全国首个创新药MAH试点品种。同样是浙江省,浙江康德药业申报的丹龙口服液则成为了国内首个中药新药上市许可持有人品种。
2.四方皆赢
理论上来说,这是一场四方皆赢的制度尝试。
首先受益的,自然是此前并不具备药品生产资格的研发企业与科研人员。MAH制度之下,研发企业与科研人员可以作为上市许可持有人持有药品批准文号,再分别委托药品生产企业与药品经营企业进行生产和销售,从而直接获得收益,其新药研发行为的积极性自然也大幅提高。
除此之外,新建生产线所需要的大量费用得以节省下来,则是一众以研发能力为核心的创新药企最看重的因素之一。华领医药此前在进行2型糖尿病用药GKA葡萄糖激酶激活剂HMS5552的二期临床试验时,是否要自建生产基地便是最为困扰华领医药CEO陈力的问题,“在没有完成二期临床之前,要投2个亿去建生产厂是不太可能的,但如果做完二期之后再启动建厂,那肯定要耽误两三年时间。”华领医药并非个例,几乎所有研发型企业都会遇到类似问题,而MAH制度的出现则是柳暗花明又一村:既然有那么多CMO企业可供选择,何必选择自己建厂这一耗时耗力的笨办法呢?
其次则是药品生产企业。尽管看上去与MAH制度关系不大,但实际上,“即便是在生产企业中,也有10%左右是委托生产。”杨胜如此表示。而这与当下诸多医药企业不断战略转型有关,例如一些传统的化药生产企业计划向大分子药、单抗药进军,或是传统的中药企业开始做化学药品,通过委托有生产能力的企业来生产,就无需再新建生产线,从而减免大量成本。
即便是出于未来生产转移等因素考虑,MAH制度对于药品生产企业来说同样至关重要,齐鲁制药所申报的全国首个获批MAH品种吉非替尼便是如此。“吉非替尼为公司持有,由自己生产,但是考虑到该产品未来市场需求有大的增长,可能需要扩产建设新厂区,需要到不同的地方建厂,拥有持有人文号的话,有利于生产转移。”齐鲁制药药品研发负责人在接受E药经理人采访时表示。
而从国家层面来说,药品创新的动力被大幅提升,药品质量将有显著改善,产业集中度将进一步提高,各方面资源进一步得到优化配置,专业分工日益明显,重复投资和建设在很大程度上得以避免。
但受益最为直接和明显的,则还是市场上的CMO/CDMO企业,即医药合同定制研发生产。
“MAH制度试点推出之前,我们多数的业务与订单都来自海外,MAH制度的施行对我们发展国内业务起到了巨大的推动作用。”CDMO企业凯莱英医药集团首席运营官杨蕊在接受E药经理人采访时表示。