高中化学基本知识点(必修)(人教版).docx(2)
3. 选择你最感兴趣的一类问题和内容,去图书馆或上网查阅资料,进行研究、调查或实验。4. 写一篇关于金属的小论文,并与同学交流。第二节 几种重要的金属化合物一、钠的重要化合物1. 氧化钠和过氧化钠思考与交流1. 回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。2. 氧化钠与水反应和氧化钙与水反应类似,请你写出氧化钠与水反应的化学方程式。实验3—5 过氧化钠与水的作用2. 碳酸钠与碳酸氢钠科学探究 碳酸钠与碳酸氢钠的性质碳酸钠粉末遇水生成含有结晶水的碳酸钠晶体水合碳酸钠(Na2CO3·xH2O)。碳酸钠晶体在干燥空气里容易逐渐失去结晶水变成碳酸钠粉末。碳酸钠和碳酸氢钠虽然都属于盐类,但它们的溶液都显碱性,这就是它们可用作食用碱或工业用碱的原因。3. 焰色反应很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。实验3—6 几种金属的焰色反应节日燃放的五彩缤纷的烟花,就是碱金属,以及锶、钡等金属化合物焰色反应所呈现的各种艳丽色彩。二、铝的重要化合物1. 氧化铝氧化铝难溶于水,却能溶于酸或强碱溶液中。2. 氢氧化铝实验3—7 可溶性铝盐与氨水的作用实验3—8 氢氧化铝与酸、强碱的作用学与问为什么常用氨水与硫酸铝溶液反应制取氢氧化铝,而不用氢氧化钠溶液呢?三、铁的重要化合物1. 铁的氧化物2. 铁的氢氧化物实验3—9 铁的氢氧化物的制取学与问Fe(OH)2和Fe(OH)3都是不溶性碱,你能写出它们与酸反应的离子方程式吗?3. 铁盐和亚铁盐(1)Fe3+的检验实验3—10 Fe3+的检验硫酸铁等含有Fe3+的盐溶液遇到KSCN溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
(2)Fe3+和Fe2+转化科学探究氧化性较强的物质遇到还原性较强的物质时,有可能发生氧化还原反应。Fe3+遇到较强的还原剂时,会被还原成Fe2+;而Fe2+在较强的氧化剂的作用下会被氧化成Fe3+。Fe2+与Fe3+在一定条件下是可以相互转化的。实践活动 铝盐和铁盐的净水作用在某些地区,井水、河水、池塘水或雨水是生活用水的主要来源。当水比较浑浊时,人们就向水缸中加入少量明矾,搅拌。过一段时间,在水缸的底部会出现很多絮状不溶物,而水却变得清澈透明了。让我们也试一试。把混有少量泥沙的浑浊水分装在3支试管中,向其中2支试管中分别加入少量明矾、硫酸铁溶液,振荡。把3支试管都放在试管架上静置,观察现象,进行比较。不加试剂加入明矾加入硫酸铁溶液2min5min第三节 用途广泛的金属材料金属材料包括纯金属和它们的合金。合金的种类和性能与成分有关,因为各种成分是可以调节的高中化学喷泉实验,所以合金的种类繁多,应用极其广泛。一、常见合金的重要应用学与问1. 初中曾学过有关合金的一些知识,你还记得什么是合金吗?合金有哪些优良的性能?2. 你知道合金在生活中有哪些用途吗?举出一些例子。1.铜合金青铜是我国使用最早的合金。
镀铝锌钢板是铝锌合金构造构成,由55%铝、43%锌与2%硅在600℃高温下凝集而构成,其整个构造由铝-铁-硅-锌,由 55%铝、43%锌与2%硅在600℃高温下凝集而构成,其整个构造由铝-铁-硅-锌,构成致密的四元结晶体的一种合金,混杂 了al的物理防守和高持久性以及zn的电化学防守个性。镀铝锌钢板是铝锌合金结构组成,由55%铝、43%锌与2%硅在600℃高温下凝固而组成,其整个结构由铝-铁-硅-锌,形成致密的四元结晶体的一种合金。宝钢彩钢板由于其合金镀层中既含有锌又含有铝,所以除了锌可以提供牺牲性保护以外,铝元素还提供。
● 对具体物质的回忆、归纳与小结:物理性质(包括颜色、状态、硬度、水溶性、熔点,有什么特殊性质等);化学性质(能与哪些物质发生反应,反应条件,生成物等);组成上有什么特点,组成与性质的关系等。● 体会化学物质和化学反应的多样性。● 体会化学实验和科学探究对学习化学的重要作用。一、金属及其化合物的化学性质1. 金属单质金属原子的最外层电子数较少,在参加化学反应时,最外层电子容易失去,因而常常表现出一定的还原性。请按以下线索归纳、整理金属单质的化学性质,填写表中的空白,并用化学方程式表示下列反应。金属NaAlFeCu金属原子失电子的趋势→逐渐减弱与氧气的作用与水的作用与酸的作用与盐溶液的作用2. 请按下列线索复习钠、铝、铁及它们的化合物之间的转化关系。(1)钠及其重要化合物Na2O2←Na→NaOH→Na2CO3←NaHCO3(2)铝及其重要化合物Al→Al2O3←Al(OH)3→AlCl3 ↓ NaAlO2(3)铁及其重要化合物Fe3O4←Fe→FeCl2→Fe(OH)2→Fe(OH)3FeCl33. 归纳同类物质的性质你可以尝试运用分类和比较的方法进一步归纳出一些规律性的知识。建议你参考“1.金属单质”,以“金属的氧化物”“金属的氢氧化物”“盐”分块复习有关金属化合物的知识,小结每类物质的通性和每种物质的特性,认识物质之间的内在联系。
二、以金属材料的发展为例,认识化学在促进社会发展中的重要作用,体会科学、技术、社会之间的相互关系第四章 非金属及其化合物第一节 无机非金属材料的主角硅一、二氧化硅和硅酸1. 二氧化硅(SiO2)地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,统称硅石。石英晶体是结晶的二氧化硅,具有不同的晶型和色彩。石英中无色透明的晶体就是通常所说的水晶,具有彩色环带状或层状的称为玛瑙。沙子中含有小粒的石英晶体。SiO2的网状结构决定了它具有优良的物理和化学性质,加上SiO2在自然界的广泛存在,从古到今都被人类广泛地应用着。思考与交流根据SiO2的存在和应用,请你分析以下问题:SiO2具有哪些物理性质?化学稳定性如何?你的根据是什么?SiO2的这些性质是由什么决定的?将你的认识写在下面的横线上,并与同学交流。物理性质: 。化学稳定性: 。2. 硅酸(H2SiO3)实验4—1 硅酸的制取二、硅酸盐硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广。硅酸盐是一大类结构复杂的固态物质,大多不溶于水,化学性质稳定。最简单的硅酸盐是硅酸钠(Na2SiO3),可溶于水,其水溶液俗称水玻璃,是制备硅胶和木材防火剂等原料。
玻意耳在化学方面进行过很多实验,如磷、氢的制备,金属在酸中的溶解以及硫、氢等物的燃烧。比粒经效应二 双功能和溢流催化作用第三节 绝缘体氧化物的金属载体相互作用一 简单绝绝体的相互作用二 沸石上的相互作用第四节 过渡金属氧化物的金属-载体相互作用:化学吸附研究得到的证据一 h2和co的化学吸附二 氧气的吸附和氢氧滴定三 氮气吸附第五节 过渡金属氧化物负载催化剂的结构信息一 x射线测量二 透射电子显微镜第六节 smsi对催化性质的影响。 理论推测和分析(从元素守恒和氧化还原反应角度) 实验验证:产生了氢气书 写 化学 方 程式 书 写 化学 方 程式 过渡:根据酸的通性可知金属铝能与盐酸反应,观察现象并写出反应化学方程式 回答:作为氢前金属,金属铝能与盐酸、硫酸反应,产生氢气。
实验4—4 氯水的漂白作用实验4—5 干燥的氯气能否漂白物质学与问氯气是一种有毒气体,但可用于自来水的杀菌消毒;使用氯气对自来水消毒时可能产生一些负面影响,因此,人们开始研究并试用一些新型自来水消毒剂。从中你得到什么启示?二、氯离子(Cl-)的检验实验4—6 氯离子的检验检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?在用AgNO3溶液检验Cl-时,一般先在被检测的溶液中滴入少量稀硝酸使其酸化,以排除干扰离子。第三节 硫和氮的化合物一、二氧化硫和三氧化硫实验4—7 二氧化硫与水的作用二氧化硫具有漂白性,它能漂泊某些有色物质。学与问品红溶液滴入亚硫酸后,为什么会褪色?加热时又显红色说明了什么?二氧化硫在适当温度并有催化剂存在的条件下,可以被氧气氧化成三氧化硫。三氧化硫也是一种酸性氧化物,它溶于水生成硫酸,工业上利用这一原理生产硫酸。三氧化硫与碱性氧化物或碱反应时生成硫酸盐。二、二氧化氮和一氧化氮在通常情况下,氮气与氧气不发生反应,但在放电条件下,它们却可以直接化合,生成无色的一氧化氮(NO)。此外,在高温条件下,氮气也能与氧气反应生成一氧化氮。一氧化氮不溶于水,在常温下很容易与空气中的氧气化合,生成二氧化氮(NO2)。
二氧化氮溶于水时生成硝酸和一氧化氮。工业上利用这一原理生产硝酸。科学探究现给你一试管二氧化氮,其他药品和仪器自选。1. 请你设计实验,要求尽可能多地使二氧化氮被水吸收。实验步骤现象解释(可用化学方程式表示)(1)(2)(3)2. 你的设计对工业上生产硝酸有什么启示?(从原料的充分利用、减少污染物的排放等方面考虑。)三、二氧化硫和二氧化氮对大气的污染二氧化硫和二氧化氮是主要的大气污染物。它们能直接危害人体健康,引起呼吸道疾病,严重时会使人死亡。大气中的二氧化硫和二氧化氮溶于水后形成酸性溶液,随雨水降下,就可能成为酸雨。由于溶解了二氧化碳,正常雨水的pH为5.6,酸雨的pH小于5.6。酸雨有很大的危害,能直接破坏农作物、森林、草原,使土壤、湖泊酸化,还会加速建筑物、桥梁、工业设备、运输工具及电信电缆的腐蚀。汽车尾气中除含有氮氧化物外,还含有一氧化碳、未燃烧的碳氢化合物、含铅化合物(如使用含铅汽油)和颗粒物等,严重污染大气。实践活动 分析空气污染的成因在人们的日常生活、生产及各种活动中,有许多做法会对空气造成污染。请每位同学发现、分析、做出判断,然后讨论交流,以加强对家乡空气质量的关注,提高环境保护意识。
自来水制作去离子,要将水先通过石英砂过滤颗粒较粗的杂质..,要使用石英蒸馏器皿,比如自来水电阻率为1900欧姆,除去有机物和二氧化碳。还有哦,蒸馏的水也很重要,蒸馏的水最好是矿泉水,其次自来水用臭氧解毒机打十分钟也好(我是用这种方法),再次只能用自来水了。但是据我所知,有一些自己蒸馏纯露出售的人,居然使用自来水进行纯露的蒸馏……。
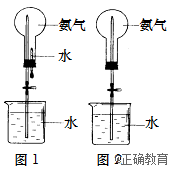
第四节 氨 硝酸 硫酸一、氨将游离态的氮转变为氮的化合物叫做氮的固定。目前工业上用氢气和氮气直接合成氨。1. 氨的性质实验4—8 氨的水溶性喷泉实验思考与交流氨经一系列反应可以得到硝酸,如下图所示。 O2 O2 O2↓ ↓ ↓N2→NH3→NO→NO2→HNO3(1)试分析上述反应中氮元素化合价的变化,以及在每一步反应中,氮元素发生的是氧化反应还是还原反应。(2)其中,氨被氧化生成一氧化氮的化学方程式为:写出其余反应的化学方程式。2. 氨的实验室制法在实验室里,常用加热铵盐和碱的混合物的方法制取氨。由于氨易溶于水,常用向下排空气法来收集。思考与交流分析图4—30(自然界中氮的循环),结合以下提示讨论。● 氮在自然界中主要以哪些形式存在?● 人体里蛋白质中的氮是从哪儿来的?● 自然界中有哪些固定氮的途径?● 简单描述氮在自然界的循环过程。● 人类的哪些活动参与了氮的循环?二、硫酸和硝酸的氧化性思考与交流(1)硫酸、硝酸、盐酸都是酸,它们在组成上有什么特点?(2)这种特点与酸的通性有什么关系?用电离方程式表示。(3)实验室里用金属与酸反应制取氢气时,往往用稀硫酸或盐酸,而不用浓硫酸或硝酸,这是为什么?浓硫酸具有很强的腐蚀性,并能按水的组成比脱去纸、棉布、木条等有机物中的氢、氧元素,也就是平时说的“脱水”。
实际上,浓硫酸还能与很多物质起反应,如能与大多数金属(如Cu)或非金属(如C)起氧化还原反应。实验4—9 铜与浓硫酸的作用有些金属如铁、铝等虽然能溶于稀硫酸或稀硝酸,但在常温下却可以用铁、铝制容器来盛装浓硫酸或浓硝酸。这是因为它们的表面被氧化为致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应。归纳与整理请按以下线索归纳硅、氯、硫、氮元素及其化合物的有关知识,并用化学方程式表示相关的反应。你也可以采用别的方式进行归纳与整理。一、硅1.性质:导电性介于导体和绝缘体之间 硅单质 用途:2.存在: 性质:二氧化硅 用途:3.制法 Na2SiO3 性质 硅酸盐 用途 硅酸盐产品:二、氯 物理性质: 与H2O反应1. 氯气 化学方程式: 用途: 化学性质 与NaOH(化学方程式、产物的用途) 与碱反应 与Ca(OH)2(化学方程式、产物的用途) 与金属Na、Fe、Cu的反应(化学方程式)2. Cl-的检验(化学方程式、试剂、操作)三、硫及其化合物S→SO2→SO3→H2SO4→MgSO4四、氮及其化合物N2→NO→NO2→HNO3→NH4NO3NH3五、环境保护二氧化硫、二氧化氮及氯气等都能对大气造成污染,人类在生产、生活中,应尽量减少污染物的排放。
撞也撞不疼人家