某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究.实验所得数据如下表.就本实验

实验1中mno2的作用是催化剂,实验2中又加入硫酸kclo3,生成气体体积增大kclo3,且为实验1中的2倍,说明二氧化锰不是催化剂,实验1中过氧化氢分解时发生反应:2h2o2 2h2o+o2↑,可知实验2中过氧化氢中氧元素全部被氧化为氧气,二氧化锰起氧化剂作用。二苯甲烷二异氰酸酯(mdi)是聚氨酯工业重要的原料之一.本文对以碳酸二甲酯为原料非光气合成二苯甲烷二异氰酸酯的绿色工艺进行了研究.首先探讨了苯氨基甲酸甲酯(mpc)缩合反应生成二苯甲烷二氨基甲酸甲酯(mdc)的工艺过程及影响因素,选择甲醛为反应甲基化试剂,固体酸为催化剂,二乙二醇二乙醚为溶剂.研究表明:a35大孔酸性树脂对mdc的合成具有较好的催化效果,其较优的工艺条件为:温度100℃,原料配比n(mpc)/n(甲醛)=6,催化剂用量10%,反应时间4h.此时,mpc的转化率可达36.3%,mdc的收率可达59.5%.缩合反应后的产物经减压蒸馏,分离提纯后可得到纯度95%以上的mdc.mdc受热分解生成mdi.研究表明:在加热过程中,mdc首先分解放出ch30h,生成mdi,然后继续热分解放出co2,生成胺类物质.金属锌可降低mdc的热分解温度,抑制过度的热分解,提高mdc的选择性.以zn为催化剂,邻苯二甲酸二辛酯为溶剂,在温度260℃时催化热分解mdc,反应20min,mdi的收率为20.9%,纯度98%.。一种将通常称为“氟利昂”的氯氟烷烃催化分解成对同温层的臭氧层无害的物质的方法,在这方法中使用包含氧化铝或氧化铝-二氧化硅复合氧化物的催化剂,其中al/(al+si)原子比率是1.0到0.5,反应是在350-1000℃温度下并有水蒸汽存在的条件下进行的。
实验
编号
KClO3(g)
氧化物
产生气体(mL)
(已折算为标况)
耗时(s)

化学式
质量(g)
实际回收
异常
188.3
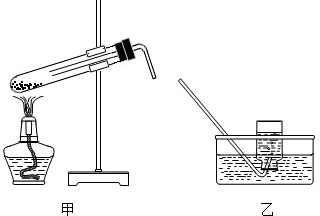
(1)本实验的装置由如图所示三部分组成,其正确的接口连接顺序为.
(2)为证明编号2的实验中MnO2起到催化作用,上述实验后还要测定反应剩余物MnO2的质量,实验的操作顺序是:溶解→→→→.
(3)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为(填物质的化学式).
(4)从编号3的实验数据,可计算出KClO3的分解率为%(保留一位小数).
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是(填化学式),常用试纸检验该气体,上述异常现象产生的原因是.
请先登录或注册查看答案
【解答】解:()根据排水法测气体体积的进气方式为:短管进气长管出水所用连接顺序为a→c→b→d故答案为:a→c→b→d(2)MnO2难溶于水测定反应剩余物MnO2的质量要溶解、过滤、洗涤、干燥、称量故答案为:过滤、洗涤、干燥、称量(3)根据生成相同体积氧气时所用时间的长短Fe2O3作催化剂用时最短MnO2作催化剂用时次之CuO作催化剂用时最长所以其催化能力从大到小的顺序为:Fe2O3 >MnO2 >CuO(4)生成氧气的物质的量为nVVm00672L224L/mol0003mol2KCl3 CuO △2KCl+3O2↑2mol                                     3mol  0002mol                              0003mol所以反应的氯酸钾的物质的量为 0002mol质量为mnM0002mol×225g/mol0245g所以其分解率为0245g06g×00%408%故答案为:408%(5)用Cr2O3做研究实验时发现有刺激性气味的气体产生同时绿色的混合物变成了橘黄色则Cr元素的化合价升高Cl元素的化合价降低氯酸钾在加热条件下将Cr2O3氧化为可溶性化合物同时生成氯气其化学式为Cl2氯气能使湿润的淀粉碘化钾试纸变蓝则可以使用湿润的淀粉碘化钾试纸检验氯气故答案为:Cl2湿润的淀粉碘化钾氯酸钾在加热条件下将Cr2O3氧化为可溶性化合物
【分析】()根据排水法测气体体积的进气方式为:短管进气长管出水(2)MnO2难溶于水测定反应剩余物MnO2的质量要溶解、过滤、洗涤、干燥、称量(3)根据生成相同体积氧气时所用时间的长短判断(4)先根据nVVm计算氧气的物质的量再根据氯酸钾和氧气的关系式计算氯酸钾的物质的量根据mnM计算反应的氯酸钾的质量再计算分解的氯酸钾与加入的氯酸钾的质量之比即可(5)根据元素守恒及题意判断生成物氯气有氧化性能使湿润的淀粉碘化钾变蓝
性质实验方案的设计
让侵略者知道中国人不是懦夫