第一章质粒DNA的分离doc下载
因此,两类菌群可能存在一个互补的作用,瘤胃真菌能把大片段植物颗粒降解成小片段,为瘤胃细菌及其丰富的酶系提供更多的作用位点。 根据细胞内有无核膜 为界限的细胞核 真核细胞(生物) 细菌 蓝藻 ( 支原体 衣原体 放线菌) 原核细胞(生物) 植物 动物 真菌 (菇类,霉菌,酵母菌) 真菌、植物、动物 细菌、蓝藻 生物类群 有核糖体、线粒体等,植物细胞还有叶绿体和液泡等 有核糖体 细胞质 细胞核:染色体 细胞质:线粒体叶绿体 拟核:大型环状 质粒:小型环状 dna 有染色体,染色体主要由dna和蛋白质结合 无染色体,环状dna不与蛋白质结合 染色体 有成形的细胞核 , 有核膜。47.基于分子大小的分离质粒dna的制备1细菌细胞在蔗糖存在时用edta和溶菌酶进行处理,可以防止细胞的立刻破裂2细胞壁被部分瓦解后形成残壁细胞,但细胞质膜仍然完好无损3利用非离子去垢剂和triton-100的诱导,防止细菌染色体断裂4离心后的裂解液上清即为质粒dna。
在细菌细胞内,共价闭环质粒以超螺旋形式存在。在提取质粒过程中,除了超螺旋DNA外,还会产生其它形式的质粒DNA。如果质粒DNA两条链中有一条链发生一处或多处断裂,分子就能旋转而消除链的张力,形成松驰型的环状分子,称开环DNA(OpencircularDNA,简称ocDNA)如果质粒DNA的两条链在同一处断裂,则形成线状DNA(LinearDNA)。当提取的质粒DNA电泳时,同一质粒DNA其超螺旋形式的泳动速度要比开环和线状分子的泳动速度快。第二章DNA酶切及凝胶电泳一DNA的限制性内切酶酶切分析限制性内切酶能特异地结合于一段被称为限制性酶识别序列的DNA序列之内或其附近的特异位点上,并切割双链DNA。它可分为三类:Ⅰ类和Ⅲ类酶在同一蛋白质分子中兼有切割和修饰(甲基化)作用且依赖于ATP的存在。Ⅰ类酶结合于识别位点并随机的切割识别位点不远处的DNA,而Ⅲ类酶在识别位点上切割DNA分子,然后从底物上解离。Ⅱ类由两种酶组成:一种为限制性内切核酸酶(限制酶),它切割某一特异的核苷酸序列另一种为独立的甲基化酶,它修饰同一识别序列。Ⅱ类中的限制性内切酶在分子克隆中得到了广泛应用,它们是重组DNA的基础。
绝大多数Ⅱ类限制酶识别长度为至个核苷酸的回文对称特异核苷酸序列(如EcoRⅠ识别六个核苷酸序列:'G↓AATTC'),有少数酶识别更长的序列或简并序列。Ⅱ类酶切割位点在识别序列中,有的在对称轴处切割,产生平末端的DNA片段(如SmaⅠ:'CCC↓GGG')有的切割位点在对称轴一侧,产生带有单链突出末端的DNA片段称粘性未端,如EcoRⅠ切割识别序列后产生两个互补的粘性末端。'…G↓AATTC…'→'…GAATTC…''…CTTAA↑G…'→'…CTTAAG…'DNA纯度、缓冲液、温度条件及限制性内切酶本身都会影响限制性内切酶的活性。大部分限制性内切酶不受RNA或单链DNA的影响。当微量的污染物进入限制性内切酶贮存液中时,会影响其进一步使用,因此在吸取限制性内切酶时,每次都要用新的吸管头。如果采用两种限制性内切酶,必须要注意分别提供各自的最适盐浓度。若两者可用同一缓冲液,则可同时水解。若需要不同的盐浓度,则低盐浓度的限制性内切酶必须首先使用,随后调节盐浓度,再用高盐浓度的限制性内切酶水解。也可在第一个酶切反应完成后,用等体积酚氯仿抽提,加倍体积molLNaAc和倍体积无水乙醇,混匀后置℃低温冰箱分钟,离心、干燥并重新溶于缓冲液后进行第二个酶切反应。
DNA限制性内切酶酶切图谱又称DNA的物理图谱,它由一系列位置确定的多种限制性内切酶酶切位点组成,以直线或环状图式表示。在DNA序列分析、基因组的功能图谱绘制、DNA的无性繁殖、基因文库的构建等工作中,建立限制性内切酶图谱都是不可缺少的环节,近年来发展起来的RFLP(限制性片段长度多态性)技术更是建立在它的基础上。构建DNA限制性内切酶图谱有许多方法。通常结合使用多种限制性内切酶,通过综合分析多种酶单切及不同组合的多种酶同时切所得到的限制性片段大小来确定各种酶的酶切位点及其相对位置。酶切图谱的使用价值依赖于它的准确性和精确程度。在酶切图谱制作过程中,为了获得条带清晰的电泳图谱,一般DNA用量约为μg。限制性内切酶的酶解反应最适条件各不相同,各种酶有其相应的酶切缓冲液和最适反应温度(大多数为℃)。对质粒DNA酶切反应而言,限制性内切酶用量可按标准体系μgDNA加单位酶,消化小时。但要完全酶解则必须增加酶的用量,一般增加倍,甚至更多,反应时间也要适当延长。二凝胶电泳琼脂糖或聚丙烯酰胺凝胶电泳是分离鉴定和纯化DNA片段的标准方法。该技术操作简便快速,可以分辨用其它方法(如密度梯度离心法)所无法分离的DNA片段。
l pcr产物在8%非变性聚丙烯酰胺凝胶上恒电压850v电泳90min.用稍加改进的naoh银染方法对电泳后的聚丙烯酰胺凝胶进行染色显影.各种溶剂的配方和体积为:银染液,0.1%agno3溶液1l。(4)凝胶色谱法是根据分离蛋白质的有效方法,电泳分离法是根据各种物质分子的的不同,使待分离样品中各分子的迁移速度不同而实现分子分离的。7)合成的cdna第―链在1.4%的碱性琼脂糖凝胶上电泳,用末端标记的pbr322限制性片段为分子量标准,电泳后,铺x-光片,进行放射自显影,确定cdna第一链的大小。
琼脂糖浓度:一个给定大小的线状DNA分子,其迁移速度在不同浓度的琼脂糖凝胶中各不相同。DNA电泳迁移率的对数与凝胶浓度成线性关系。凝胶浓度的选择取决于DNA分子的大小。分离小于kb的DNA片段所需胶浓度是,分离大于kb的DNA分子所需胶浓度为,DNA片段大小间于两者之间则所需胶浓度为。DNA分子的构象:当DNA分子处于不同构象时,它在电场中移动距离不仅和分子量有关,还和它本身构象有关。相同分子量的线状、开环和超螺旋DNA在琼脂糖凝胶中移动速度是不一样的,超螺旋DNA移动最快,而线状双链DNA移动最慢。如在电泳鉴定质粒纯度时发现凝胶上有数条DNA带难以确定是质粒DNA不同构象引起还是因为含有其他DNA引起时,可从琼脂糖凝胶上将DNA带逐个回收,用同一种限制性内切酶分别水解,然后电泳,如在凝胶上出现相同的DNA图谱,则为同一种DNA。电源电压:在低电压时,线状DNA片段的迁移速率与所加电压成正比。但是随着电场强度的增加,不同分子量的DNA片段的迁移率将以不同的幅度增长,片段越大,因场强升高引起的迁移率升高幅度也越大,因此电压增加,琼脂糖凝胶的有效分离范围将缩小。要使大于kb的DNA片段的分辨率达到最大,所加电压不得超过vcm。
嵌入染料的存在:荧光染料溴化乙啶用于检测琼脂糖凝胶中的DNA,染料会嵌入到堆积的碱基对之间并拉长线状和带缺口的环状DNA,使其刚性更强,还会使线状DNA迁移率降低%。离子强度影响:电泳缓冲液的组成及其离子强度影响DNA的电泳迁移率。在没有离子存在时(如误用蒸馏水配制凝胶),电导率最小,DNA几乎不移动,在高离子强度的缓冲液中(如误加×电泳缓冲液),则电导很高并明显产热,严重时会引起凝胶熔化或DNA变性。对于天然的双链DNA,常用的几种电泳缓冲液有TAE含EDTA(pH)和Tris乙酸,TBE(Tris硼酸和EDTA),TPE(Tris磷酸和EDTA),一般配制成浓缩母液,储于室温。第三章大肠杆菌感受态细胞的制备和转化转化(Transformation)是将外源DNA分子引入受体细胞,使之获得新的遗传性状的一种手段,它是微生物遗传、分子遗传、基因工程等研究领域的基本实验技术。转化过程所用的受体细胞一般是限制修饰系统缺陷的变异株,即不含限制性内切酶和甲基化酶的突变体(Rˉ,Mˉ),它可以容忍外源DNA分子进入体内并稳定地遗传给后代。受体细胞经过一些特殊方法(如电击法,CaCl,RbCl(KCl)等化学试剂法)的处理后,细胞膜的通透性发生了暂时性的改变,成为能允许外源DNA分子进入的感受态细胞(Compenentcells)。
于是,研究者提出,加热杀死的有荚菌培养物或其无细胞抽提物中,一定存在着某种导致细菌类型发生转化的物质第一个作为重组dna载体的质粒,可是人们包括格里菲斯并没有认识到这其中已经包含了遗传物质的传递,只是为了便于研究,暂时叫做“转化因子”。本实验要加入psv-neo、dna于外源dna共转染受体细胞,这样可使受体细胞获得新霉素(neo)基因的抗药性,这样即使癌基因没有出现明显的“转化灶”,也可测出转入的外源性基因的抗新霉素的标记。本实验要加入psv2-neo、dna与外源dna共转染受体细胞,这样可使受体细胞获得新霉素(neo)基因的抗药性,这样即使癌基因没有出现明显的“转化灶”,也可测出转入的外源性基因的抗neo的标记。
ng的cccDNA即可使μl的感受态细胞达到饱和。一般情况下,DNA溶液的体积不应超过感受态细胞体积的%。试剂的质量:所用的试剂,如CaCl等均需是最高纯度的(GR或AR),并用超纯水配制,最好分装保存于干燥的冷暗处。防止杂菌和杂DNA的污染:整个操作过程均应在无菌条件下进行,所用器皿,如离心管,tip头等最好是新的,并经高压灭菌处理,所有的试剂都要灭菌,且注意防止被其它试剂、DNA酶或杂DNA所污染,否则均会影响转化效率或杂DNA的转入,为以后的筛选、鉴定带来不必要的麻烦。第五章重组质粒的连接、转化及筛选第一节概述质粒具有稳定可靠和操作简便的优点。如果要克隆较小的DNA片段(<kb)且结构简单,质粒要比其它任何载体都要好。在质粒载体上进行克隆,从原理上说是很简单的,先用限制性内切酶切割质粒DNA和目的DNA片段,然后体外使两者相连接,再用所得到重组质粒转化细菌,即可完成。但在实际工作中,如何区分插入有外源DNA的重组质粒和无插入而自身环化的载体分子是较为困难的。通过调整连接反应中外源DNA片段和载体DNA的浓度比例,可以将载体的自身环化限制在一定程度之下,也可以进一步采取一些特殊的克隆策略,如载体去磷酸化等来最大限度的降低载体的自身环化,还可以利用遗传学手段如α互补现象等来鉴别重组子和非重组子。
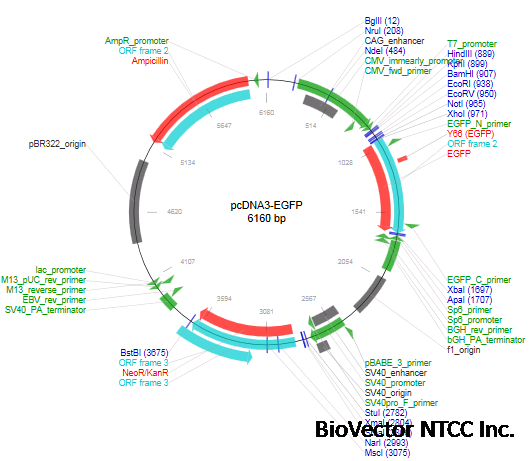
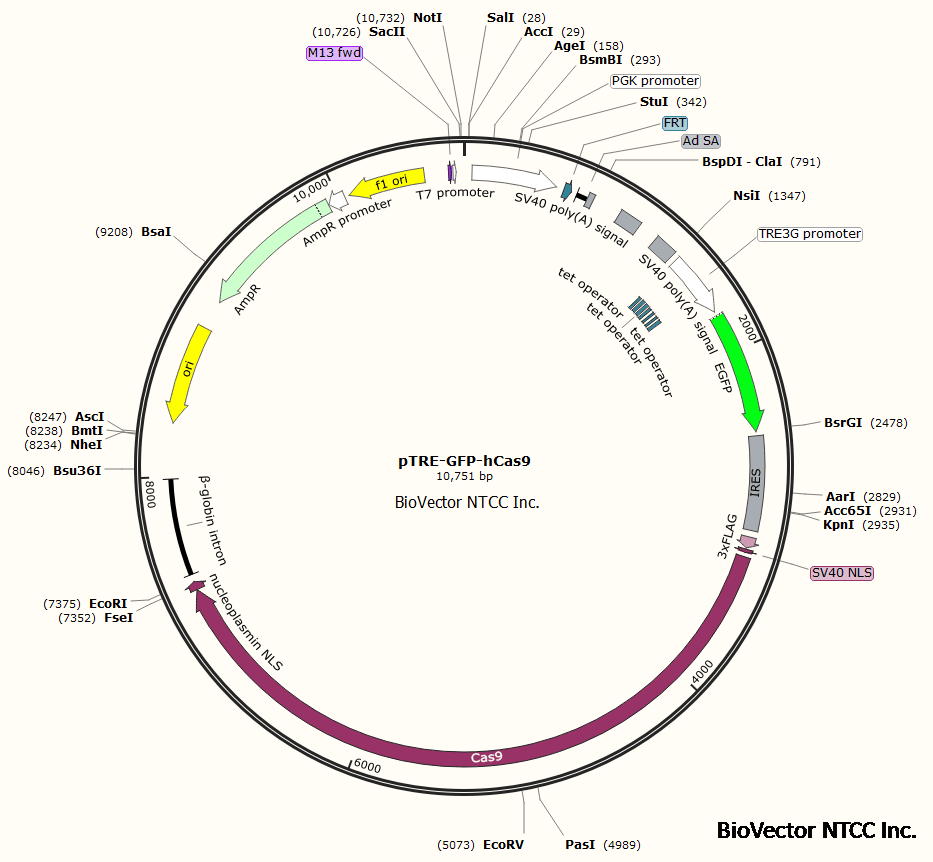
据已测序的上西早生柿etr5基因序列,设计了2对带限制性内切酶位点的特异性引物,以测序质粒为模板,pcr扩增到2个etr5-uenishiwase基因片段.2个片段经单酶切消化后连接成反向互补的大片断.连接片断经双酶切消化后,定向连接到植物表达载体psmak321的35s启动子和nos终止子之间,构建成uenishiwase-etr5基因的rna干扰植物表达载体.载体质粒经酶切鉴定正确后通过冻融法转入根癌农杆菌eha101中.以上西柿组培苗叶片为外植体,优化遗传转化体系,结果表明:农杆菌重悬液和共培养基中均添加200 μmol/l的as及spc梯度筛选能有效提高转化率.转化植株经pcr检测得到7株阳性植株.。在载体中进行重组:通过限制内切酶将两个dna片段进行酶切并回收。 1、基因敲除小鼠 2、基因敲入小鼠 3、基因捕获小鼠 4、转基因小鼠 5、条件性基因表达小鼠 6、条件性基因敲除小鼠 基因修饰小鼠 载体构建基本知识 二、pires2-egfp-rtta advanced 构建 使用引物将rtta advanced cds区克隆出来,然后以xhoi/bglii双酶切,将其克隆入pires2-egfp载体的xhoi/bamhi位点中。
由于平端的连接效率比粘性末端要低得多,故在其连接反应中,TDNA连接酶的浓度和外源DNA及载体DNA浓度均要高得多。通常还需加入低浓度的聚乙二醇(PEG)以促进DNA分子凝聚成聚集体的物质以提高转化效率。特殊情况下,外源DNA分子的末端与所用的载体末端无法相互匹配,则可以在线状质粒载体末端或外源DNA片段末端接上合适的接头(linker)或衔接头(adapter)使其匹配,也可以有控制的使用EcoliDNA聚合酶Ⅰ的klenow大片段部分填平'凹端,使不相匹配的末端转变为互补末端或转为平末端后再进行连接。本实验所使用的载体质粒DNA为pBS,转化受体菌为EcoliDHα菌株。由于pBS上带有Ampr和lacZ基因,故重组子的筛选采用Amp抗性筛选与α互补现象筛选相结合的方法。因pBS带有Ampr基因而外源片段上不带该基因,故转化受体菌后只有带有pBSDNA的转化子才能在含有Amp的LB平板上存活下来而只带有自身环化的外源片段的转化子则不能存活。此为初步的抗性筛选。pBS上带有β半乳糖苷酶基因(lacZ)的调控序列和β半乳糖苷酶N端个氨基酸的编码序列。这个编码区中插入了一个多克隆位点,但并没有破坏lacZ的阅读框架,不影响其正常功能。
伊凡份子给老萨提鞋的资本都木油