如图是喷泉实验装置图.下列说法正确的是( )A.烧瓶中的溶液

(7)乙烯和水在催化剂作用下加成生成乙醇,乙醇氧化生成乙醛,乙醛在题给信息的条件下反应生成,在浓硫酸加热条件下发生消去反应生成chcho在催化剂、氧气加热条件下发生催化氧化生成和乙醇发生酯化反应,即可得物质e,合成路线为:答案 (1)(2)浓hno3和浓h2so4(3) (4)碳碳双键、酯基(5)加聚反应(6) +nc2h5oh原创总结有机合成路线设计思维导图(2016·江苏,20(5))化合物h是合成抗心律失常药物的一种中间体,可通过以下方法合成:已知:1.苯胺易被氧化请以甲苯和(ch3co)2o为原料制备,写出制备的合成路线流程图(无机试剂任用)。氮基气氛用于保护热处理和化学热处理,可以实现无氧化脱碳热处理,并可以避免热处理氮脆,氮基气氛的化学热处理,可以减少内氧化等缺陷,提高化学热处理质量。氮基气氛,用于保护热处理和化学热处理,可以实现无氧化脱碳热处理,并可以避免热处理氮脆,氮基气氛的化学热处理,可以减少内氧化等缺陷,提高化学热处理质量。
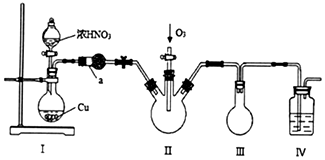
(1)铜和浓硝酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.加入浓硝酸后,装置Ⅰ中烧瓶上部可观察到的现象是有红棕色气体生成.
(2)仪器a的名称为球形干燥管,该仪器中盛装的试剂是D(填标号).
A.生石灰B.浓硫酸C.碱石灰D.五氧化二磷
(3)已知下列物质的有关数据.
物质

熔点/℃
沸点/℃
32(升华)
四大的本义是说,构成这个世界的物质有四种基本形态:固态、液态、气态,这和经典物理学说的一样,物质有气体、固体、液体三种形式。在一定压力与温度下,将生物质原料干燥并粉碎,之后压合成燃烧效率与燃烧性能较高的高密度规则固体,大幅度降低了储藏与运输费用,为生物质燃料的工业生产以及广泛引用提供了可能。13、解释:亚硫酸钠是固体,稀盐酸是液体,条件是在常温下反应生成气体,所以发生装置应该用b装置,因为二氧化硫密度比空气大所以应该用向上排空气法,导管插到集气瓶底部才能使收集的气体比较纯净。
(4)装置Ⅲ的作用是安全瓶,防止倒吸.
(6)由题意9的反应提示,以为主要原料,经最少步骤制备含肽键聚合物的流程为:答案(1)413(2)2-硝基甲苯或邻硝基甲苯(3)避免苯环上甲基对位的氢原子被硝基取代(或减少副产物,或占位)(4)+hcl保护氨基(5)cl2/fecl3(或cl2/fe)羧基.(2017·江苏化学,17)化合物h是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:(1)c中的含氧官能团名称为和。四 涉及氧传递的膜催化反应五 c1-化学中的膜催化转化第四节 展望参考文献第六章 催化剂的分子设计第一节 概述第二节 对分子设计的了解第三节 分子设计的基础一 理论化学和模拟二 分析仪器三 表面科学四 金属有机化学五 分子筛科学六 反应工程第四节 催化剂的设计――开创未来一 现有产品的可替代工艺的开发二 现有产品的新工艺的开发三。资料摘要 1-(2′,4′,6′-三氯苯基)-3-(2′-氯-5′-硝基)苯胺基吡唑酮-5的制备属于有机化合物的合成方法.系采用2-氯-5*和β-乙氧基-β-亚胺基丙酸乙酯*盐为原料,以甲醇或无水乙醇为介质进行缩合,反应完毕减压下蒸除溶剂.然后加入冰醋酸、无水醋酸钠以及2,4,6-三氯苯肼*盐再进行缩合闭环制得.1-(2′,4′,6′-三氯苯基)-3-(2′-氯-5′-硝基)苯胺基吡唑酮-5系有机中间体,可用于制备彩色照相材料用品红成色剂.。
[0010]一种由工业芴制备9-芴酮的方法,以碱为催化剂,以甲苯和水为溶剂,以季铵盐为相转移剂,以乙醇为重结晶溶剂,具体包括如下步骤:。(7)乙烯和水在催化剂作用下加成生成乙醇,乙醇氧化生成乙醛,乙醛在题给信息的条件下反应生成,在浓硫酸加热条件下发生消去反应生成chcho在催化剂、氧气加热条件下发生催化氧化生成和乙醇发生酯化反应,即可得物质e,合成路线为:答案 (1)(2)浓hno3和浓h2so4(3) (4)碳碳双键、酯基(5)加聚反应(6) +nc2h5oh原创总结有机合成路线设计思维导图(2016·江苏,20(5))化合物h是合成抗心律失常药物的一种中间体,可通过以下方法合成:已知:1.苯胺易被氧化请以甲苯和(ch3co)2o为原料制备,写出制备的合成路线流程图(无机试剂任用)。(6)由题意9的反应提示,以为主要原料,经最少步骤制备含肽键聚合物的流程为:答案(1)413(2)2-硝基甲苯或邻硝基甲苯(3)避免苯环上甲基对位的氢原子被硝基取代(或减少副产物,或占位)(4)+hcl保护氨基(5)cl2/fecl3(或cl2/fe)羧基.(2017·江苏化学,17)化合物h是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:(1)c中的含氧官能团名称为和。

②N2O5生成对硝基甲苯的转化率为21.05%.
20.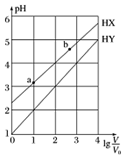 浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是()
浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是()
常温下,由水电离出的c(H+)•c(OH-):a<b
HX、HY都是弱酸,且HX的酸性比HY的弱
相同温度下,电离常数K(HX):a>b
lg$\frac{v}{{v}_{0}}$=3高中化学喷泉实验,若同时微热两种溶液(不考虑HX、HY和H2O的挥发)高中化学喷泉实验,则$\frac{c({X}^{-})}{c({Y}^{-})}$减小
14.分子式为C8H8O2的属于酯类的芳香族化合物共有()

1.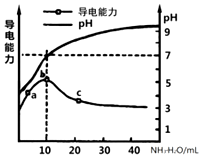 常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是()
常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是()
a~b点导电能力增强说明HR为弱酸
a、b点所示溶液中水的电离程度不相同
b恰好完全中和,pH=7说明NH4R没有水解
c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
11.工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素).
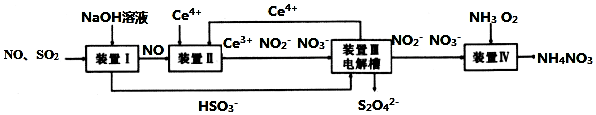

请回答下列问题.
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,氧化亚铁具有还原性,能被二氧化碳氧化生成四氧化三铁或氧化铁,同时生成co,反应方程式为2feo+co2fe2o3+co(或生成fe3o4),如果该反应发生,则生成固体中含有三价铁,将固体溶于稀盐酸生成铁离子,铁离子和kscn溶液反应生成血红色物质而使溶液变红色.。二氧化碳是酸性氧化物的代表物,与氧气相比化学性质更为复杂,可以与水反应生成碳酸,可以与氢氧化钠、氢氧化钙发生反应,二氧化碳的学习丰富了学生了解的物质类别和物质间的反应关系。(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(3)根据化合物中元素的质量分数及一定质量的物质中元素的质量计算方法来解答.解答:解:(1)由“瘦肉精”的化学式为c12h18cl2n2o,则1个分子中含有12个碳原子、18个氢原子、2个氯原子、2个氮原子、1个氧原子,即碳、氢、氯、氮、氧的原子个数比为12:18:2:2:1,故答案为:12:18:2:2:1。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.

①下列说法中正确的是BD(填标号).
A.NaHSO3溶液中滴加氯水可以使c(HSO3-)/c(SO32-)的值变大
B.pH=7时,溶液中c(Na+)>c(HSO3-)+c(SO32-)
C.pH=9时的溶液中c(OH-)=c(H+)+c(HSO3-)+c(H2SO3)
D.由图1中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
E.由图1中数据,pH=5和pH=9时的溶液中水的电离程度相同
半张脸然而还是宋