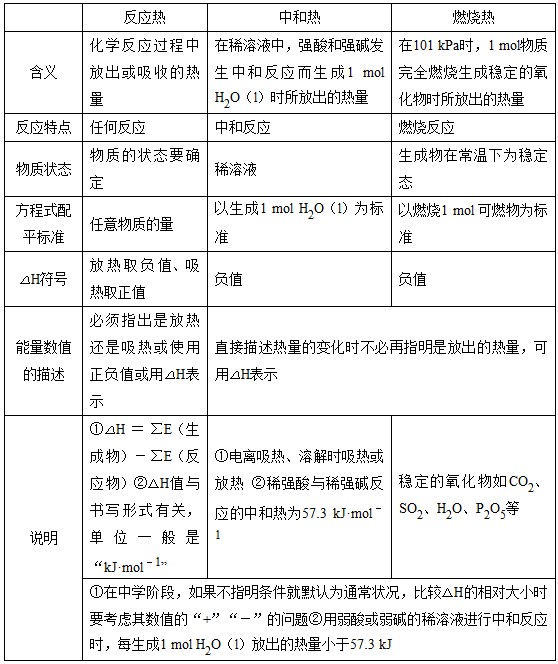
反应热、中和热、燃烧热的联系与区别

3.化学反应速率和化学平衡:化学反应速率,影响化学反应速率的因素(浓度、温度、催化剂),基元反应,质量作用定律,反应速率方程,反应级数,阿伦尼乌斯方程式,碰撞理论,活化能,活化分子,过渡态理论,活化能与反应速率的关系,平衡常数(实验平衡常数,标准平衡常数(kӨ)),多重平衡规则,kӨ与&delta。a′b′确定 o2/vxv=a′+b′/nrs a′ 0.42---0.53 b′ 0.188---0.114.3 活性污泥反应动力学基础 一. 概述 研究目的 {①研究反应速度和环境因素间的关系 {②对反应的机理进行研究,使反应进行控制 反应动力学方程式 {米门方程式 1913 研究酶促反应速度污泥减量微生物制剂 污泥减量微生物制剂提供商 {莫诺方程式 1942 {劳—麦方程式 1970 二. 莫诺方程式 1. 基本方程式形式 提出人:莫诺 时间: 物的培养基中 试验内容:研究微生物的增值速度与底物浓度间的关系 结果与米门方程式相同 。试卷中每个模块设一道非选择题,新课标卷生物部分再无双选、自然灾害与防治,增加为“12选择+4填空”总分值80分,而更多的是“做完了没”,多做者只批阅第一题,广东卷历年考法皆为前后句子填空,全国卷理解句意填空的考查方式难度较大,每年广东卷中的双选题都让考生很“痛苦”,更需要做到理解记忆,生物双选题都是一部分基础知识不够扎实的广东考生“心头的痛”,总分与考试时长相等、20实际的战争与和平、具体题型分值分布上,均设置必考和选考内容,只会是某一大题的一小问、翻译皆为广东卷常设题型。
反应热
中和热
燃烧热
化学反应过程中放出或吸收的热量

在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量
在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量
反应特点
任何反应
中和反应

燃烧反应
物质状态
物质的状态要确定
稀溶液
生成物在常温下为稳定态

方程式配平标准
任意物质的量
以生成1 mol H2O(l)为标准
以燃烧1 mol 可燃物为标准
放热取负值、吸热取正值
能量数值的描述
必须指出是放热还是吸热或使用正负值或用△H表示
直接描述热量的变化时不必再指明是放出的热量,可用△H表示
①△H=∑E(生成物)-∑E(反应物)②△H值与书写形式有关,单位一般是“kJ·mol-1”
①电离吸热、溶解时吸热或放热 ②稀强酸与稀强碱反应的中和热为57.3 kJ·mol-1
稳定的氧化物如CO2、SO2、H2O、P2O5等
①在中学阶段,如果不指明条件就默认为通常状况,比较△H的相对大小时要考虑其数值的“+”“-”的问题②用弱酸或弱碱的稀溶液进行中和反应时,每生成1 mol H2O(l)放出的热量小于57.3 kJ
不能根据反应条件是否需要加热来判断一个反应是放热反应还是吸热反应,因为有些放热反应需要加热才能进行,而有些吸热反应在常温下也可自发进行。
对于某些尚未测定出生成焓的化合物,甚至对可能合成的新化合物,可根据键焓的数据估算它们的生成焓和相关的反应焓,这是因为反应热效应为反应过程中旧键断裂和新键形成所想起的。3.化学反应速率和化学平衡:化学反应速率,影响化学反应速率的因素(浓度、温度、催化剂),基元反应,质量作用定律,反应速率方程,反应级数,阿伦尼乌斯方程式中和热和燃烧热的区别,碰撞理论,活化能,活化分子中和热和燃烧热的区别,过渡态理论,活化能与反应速率的关系,平衡常数(实验平衡常数,标准平衡常数(kӨ)),多重平衡规则,kӨ与&delta。反应有三个分子,反应后剩余一个,则反应了两个,反应前有一个分子,反应后没有,则参加了反应,反应后应该生成了两个分子,所以应再填一个。
直接问问他