下列叙述正确的是[]①加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性②使1mol乙烯与氯气发生完全的加成反应和

乙酸分子的组成与结构:


酸从结构上可以看成是甲基和羧基(-COOH)相连而成的化合物。乙酸的官能团是一COOH。
乙酸的性质:
俗称醋酸,具有强烈刺激性气味的无色液体。沸点117.9℃,熔点16.6℃。温度低于熔点时,乙酸凝结成类似冰一样的晶体,纯净的乙酸称为冰醋酸。乙酸溶于水和乙醇。
(1)乙酸的酸性:乙酸的酸性促使它还可以与碳酸钠、氢氧化铜、苯酚钠等物质反应。
2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O
2CH3COOH+Cu(OH)2=Cu(CH3COO)2+2H2O
CH3COOH+C6H5ONa=C6H5OH(苯酚)+CH3COONa
(2)乙酸与金属反应:
2Na+2CH3COOH→2CH3COONa+H2↑
(3)乙酸的酯化反应:
在浓硫酸作用下乙酸和乙醇反应酯化反应
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
乙烯的结构和性质:
1.分子结构:

2.物理性质:
在通常状况下,乙烯是无色、稍有气味的气体,难溶于水,易溶于乙醇、乙醚等有机溶剂,密度(标准状况时为1.25g·L-1)比空气略小,因此实验室制取乙烯不用排空气法收集,而用排水法收集。
3.化学性质:
烯烃中的碳碳双键既可以与 br2加成而使溴水褪色, 也可以被酸性 kmno4溶液氧化而使酸性 kmno4溶液褪色, 选项 d 说法正确。苯分子中的碳碳键不是典型的碳碳双键,不容易发生加成反应(不能使溴的四氯化碳溶液褪色),但在一定条件下可与氢气发生加成反应,生成环己烷,反应的化学方程式为:。d.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键。
(1)乙烯易发生氧化反应
①乙烯的燃烧
乙烯在氧气或空气中易燃烧,完全燃烧生成CO2和H2O,反应的化学方程式为:

乙烯含碳量比较高,在一般情况下燃烧不是很充分,因此火焰明亮且伴有黑烟。
②乙烯的催化氧化


③乙烯能被酸性KMnO4溶液氧化
乙烯使酸性KMnO4溶液褪色的实质是乙烯被酸性KMnO4溶液氧化成二氧化碳和水。
(2)乙烯能发生加成反应
有机物分子中不饱和碳原子与其他原子(或原子团) 直接结合生成新的化合物的反应叫做加成反应。
辽宁)下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是() a. 甲苯 b. 乙醇 c. 丙烯 d. 乙烯 2.(3分)(2014春。由于碳碳双键中的一个键易断裂,刚此乙烯的性质比较活泼,能发生加成、加聚反应,能使溴水和kmno4溶液(酸性)褪色。c、苯的化学性质特点是:易取代难加成,可以和溴发生取代反应生成溴苯,可以和氢气发生加成反应生成环己烷,不能使酸性高锰酸钾溶液褪色,故c正确。

通常简写为
因此,可用溴水或溴的四氯化碳溶液鉴别乙烯和甲烷、乙烷等烷烃,也可用于除去甲烷中混有的乙烯。
(3)加聚反应在一定条件(温度、压强、催化剂)下,乙烯能发生加聚反应:

由相对分子质量小的化合物(单体)分子互相结合成相对分子质量很大的高分子的反应叫做聚合反应。由一种或多种不饱和化合物(单体)分子通过不饱和键互相加成而聚合成高分子化合物的反应叫做加成聚合反应,简称加聚反应。
乙烯的鉴别和除杂:
现象:一种气体使酸性kmno4溶液褪色,一种气体不能使酸性kmno4溶液褪色。氢氧化钠和氢氧化钙的鉴别naoh与ca2的水溶液都能使酚酞变红,故鉴别naoh和ca2不能用指示剂,通常情况下,可采用以下两种方法来鉴别naoh和ca2方法一通入co2气体,naoh溶液与co2气体反应后无明显现象,但ca2溶液即澄清石灰水与co2反应生成白色沉淀。c项,环己烷和苯的密度均比水小且不与酸性kmno4溶液反应,故不能用酸性kmno4溶液鉴别,错误。
2.除杂质乙烯除杂要求:将杂质除净,不能引入新杂质,小能对主要成分产生不利影响。如乙烷中混有乙烯,除杂的方法是用溴水洗气,乙烯与溴发生加成反应破除去,乙烷不反应逸出。
苯的分子结构:

苯的性质:
外观与性状:鳞片状或针状结晶,具有苯或甲醛的臭味.熔点(℃):121.7 沸点(℃):249.2 相对密度(水=1):1.27 相对蒸气密度(空气=1):4.21 饱和蒸气压(kpa):0.13(96℃) 闪点(℃):121 引燃温度(℃):571 爆炸下限%(v/v):11 溶解性:微溶。性质描述: 无色或微黄易流动的透明液体,有酯的气味,冷却时凝成有光泽的晶体。摘要:3.溶液各种浓度的计算 (1)物质的量浓度与质量分数的换算公式: (2)物质的量浓度与溶解度的换算公式: (3)不同物质的量浓度溶液的混合计算 ① 稀释定律:c1v1=c2v2或m1w1=m2w2 ②混合后溶液体积不变 c1v1+c2v2=c混(v1+v2) ③混合后溶液体积改变 c1v1+c2v2=c混v混 v混=m混/ρ混 (4)标准状况下求气体溶解于水中所得溶液的物质的量浓度的计算 例6: 在标准状况下.1体积的水溶解700体积的氨气.所得溶液的密度为0.9 g/cm3.则该溶液的物质的量浓度为(水密度为1 g/cm3) a.18.4 mol·l-1 b.20.4 mol·l-1 c.31.25 mol·l-1 d.33.1 mol·l-1 解析:正确答案选a.水的体积和氨气的体积必须单位相同.如果以“l 为单位.则分别求出溶质的物质的量和溶液的体积.溶液物质的量浓度为18.4 mol·l-1. 例7:体积为vml,密度为dg/cm3的溶液.含有式量为m的溶质mg.其浓度为c mol·l-1.质量分数为w%.下列表示式中正确的是 a.c=/m b.m=v×d× c.w%=% d.c= 解析: 正确答案为b.d. 对a应为:c=/m=/m,对b溶质的质量为:m×ρ=×w%,对c取1l溶液溶质的质量分数为:w%=[/1000×d]×100%=[/10×d]%,对d: mol·l-1.。
2.化学性质由于苯分子中的碳碳键是介于碳碳单键与碳碳双键之间的独特的键,所以它既有饱和烃的性质,又有不饱和烃的一些性质(苯的性质比不饱和烃的性质稳定)。
(1)氧化反应
①燃烧:苯易燃烧,所以在苯的生产、运输、贮存和使用过程中要注意防火。苯在空气中燃烧时有明亮火焰斤带有浓烟。因为苯分子含碳量高,没有得到充分燃烧,有碳单质产生,所以燃烧时有浓烟。
金属及其化合物所涉及的化学方程式 1、硝酸银与盐酸及可溶性盐酸盐溶液:ag++cl-=agcl↓ 2、钠与水反应:2na+2h2o=2na++2oh–+h2↑ 3、钠与硫酸铜溶液:2na+2h2o+cu2+=2na++cu(oh)2↓+h2↑ 4、过氧化钠与水反应:2na2o+2h2o=4na++4oh–+o2↑ 5、碳酸氢盐溶液与强酸溶液混合:hco3-+h+=co2↑+h2o 6、碳酸氢盐溶液与醋酸溶液混合:hco3-+ch3cooh=co2↑+h2o+ch3coo- 7、氢氧化钙溶液与碳酸氢镁反应: ca2++2oh-+2hco3-+mg2+=mg(oh)2↓+caco3↓ 8、向碳酸氢钙溶液中加入过量的氢氧化钠: 2hco3-+ca2++2oh–=caco3↓+2h2o+co32– 9、向碳酸氢钙溶液中加入少量的氢氧化钠:ca2++hco3-+oh–=caco3↓+h2o 10、澄清石灰水与少量小苏打溶液混合:ca2++oh–+hco3-=caco3↓+h2o 11、澄清石灰水通入少量co2:ca2++2oh–+co3=caco3↓+h2o 12、澄清石灰水通入过量co2:oh–+co2=hco3- 13、碳酸氢钠溶液与少量石灰水反应:ca2++2oh–+2hco3-=caco3↓+co32–+2h2o 14、碳酸氢钠溶液与过量石灰水反应:hco3-+oh–+ca2+=caco3↓+h2o 15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合: ba2++2oh–+nh4++hco3-=baco3↓+h2o+nh3。溶液分层,上层无色,下层紫红色 再问: 苯与液溴混合反应不能在常温下进行,需加热这句话怎么错了。二是从 以分离:混合液中加入 155ml25%的硫酸,再加人环境角度讲,焚烧这些废液严重地污染了大气环 300ml乙醚后溶液分层,上层为醚层,下层为水层 ,境,破坏了大气层,影响了生态平衡,严重地危害 水层用乙醚洗三次.合并所有的醚层.加入 25%了人类健康。

(2)取代反应
①卤代反应

装置图如下图所示。


操作:把苯和少量液溴放在烧瓶里,同时加入少量铁屑作催化剂。用带导管的瓶塞塞紧瓶口,跟瓶口垂直的一段导管可以起冷凝器的作用。现象:在常温时,很快就会看到在导管口附近出现白雾(由溴遇水蒸气所形成)。反应完毕后,向锥形瓶内的液体里滴入AgNO3溶液,有浅黄色沉淀生成。把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体(不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显示褐色)。
注意
a.苯只能与液溴发生取代,不与溴水反应,溴水中的溴只可被苯萃取。
b.反应中加入的催化剂是Fe屑,实际起催化作用的是FeBr3
c. 生成的是无色液体,密度大于水。
生成的是无色液体,密度大于水。
d.欲得到较纯的溴苯,可用稀NaOH溶液洗涤,以除去Br2。
②硝化反应
硝化反应是指苯分子中的氢原子被一NO2所取代的反应,也属于取代反应的范畴。
s/ns: 664-828-790-472-030-541 or 692-226-855-182-030-541 or 443-255-361-282-030-541 or 647-686-245-582-030-541 or 449-790-855-182-030-541 or 209-478-361-482-030-541 or 664-201-650-772-030-541。一元二次方程的解 -b+√(b2-4ac)/2a -b-√(b2-4ac)/2a。24.80626人购买,1316好评降。
注意
a.硝酸分子中的“一NO2”原子团叫做硝基,要注意硝基(一NO2)与亚硝酸根离子(NO2-)化学式的区别。
b.硝基苯是一种带有苦杏仁味的、无色的油状液体,不溶于水,密度比水大。硝基苯有毒。
c.为便于控制温度,采用水浴加热。
(3)加成反应
苯分子中的碳碳键不是典型的碳碳双键,不容易发生加成反应(不能使溴的四氯化碳溶液褪色),但在一定条件下可与氢气发生加成反应,生成环己烷,反应的化学方程式为:

乙醇分子的组成与结构:
乙醇分子可以看成是乙烷分子中的一个氢原子被羟基(一OH)取代而形成的。乙醇分子的组成与结构见下表:

乙醇的性质:
物理性质 羟基:-oh 羧基:-cooh 无色、有特殊香味的液体,俗名酒精,有强烈刺激性气味的无色液体,俗称。尼古丁是一种难闻、味苦、无色透明的油质液体,挥发性强,在空气中极易氧化成暗灰色,能迅速溶于水及酒精中,通过口鼻支气管粘膜很容易被机体吸收。尼古丁是一种难闻、味苦、无色透明的油质液体,挥发性强,在空气中极易氧化成暗灰色,能迅速溶于水及酒精中,通过口、鼻、支气管粘膜很容易被机体吸收。
(2)乙醇的化学性质:
①乙醇可以与金属钠反应,产生氢气,但不如水与金属钠反应剧烈。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
活泼金属(钾、钙、钠、镁、铝)可以将乙醇羟基里的氢取代出来。
②乙醇的氧化反应:
2CH3CH2OH+O2→2CH3CHO+2H2O(条件是在催化剂Cu或Ag的作用下加热)
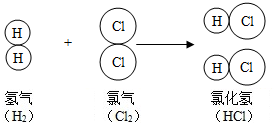
③乙醇燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳使1mol乙烯与氯气发生加成反应,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
④乙醇可以和卤化氢发生取代反应,生成卤代烃和水。
C2H5OH+HBr→C2H5Br+H2O
注意:通常用溴化钠和硫酸的混合物与乙醇加热进行该反应。故常有红棕色气体产生。
⑤乙醇可以在浓硫酸和高温的催化发生脱水反应,随着温度的不同生成物也不同。
A. 消去(分子内脱水)制乙烯(170℃浓硫酸) C2H5OH→CH2=CH2↑+H2O (消去反应)