初中化学知识点总结:溶解度

1、称取20g碘化钾溶于约25ml水中,边搅拌边分次少量加入二氯化汞(hgcl2)结晶粉末(约10g),至出现朱红色沉淀不易溶解时,该为滴加饱和的二氧化汞溶液,并充分搅拌,出现朱红色沉淀不在溶解时,停止加氯化汞溶液。下面的实验,读者也可以去试一试:把1 ml~2 ml从鸡蛋里取出的蛋清放进试管里,用水只稀释5~10倍,当逐滴加入硫酸铜的浓溶液时(不必饱和),你会发现这样的现象:生成白色沉淀的现象非常明显,但是当滴入过量硫酸铜溶液时,沉淀会逐渐溶解使溶液变的澄清。考点三 表格分析型实验题的正误判断 12.(2016·全国甲卷)下列实验操作能达到实验目的的是()选项 实验目的 实验操作 a 制备fe(oh)3胶体 将naoh浓溶液滴加到饱和fecl3溶液中 b 由mgcl2溶液制备无水mgcl2 将mgcl2溶液加热蒸干 c 除去cu粉中混有的cuo 加入稀硝酸溶解,过滤、洗涤、干燥 d 比较水与乙醇中氢的活泼性 分别将少量钠投入到盛有水和乙醇的烧杯中 解析:选da项中,制备fe(oh)3胶体,应把饱和fecl3溶液逐滴加入到沸水中,继续煮沸至溶液呈红褐色,反应为fecl3+3h2ofe(oh)3(胶体)+3hcl。
1、饱和溶液和不饱和溶液的概念:
饱和溶液:在一定温度下(溶质为气体时还需在一定压强下),向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液,叫做这种溶质在这种溶剂里的饱和溶液。
第一,物质的量浓度适合于表示不饱和及饱和溶液中溶质与溶剂的关系,不适合于过饱和溶液(溶质未溶解完全)。气体的溶解度有两种表示方法,一种是在一定温度下,气体的压强(或称该气体的分压,不包括水蒸气的压强)是1.013×10^5pa时,溶解于一体积水里,达到饱和的气体的体积(并需换算成在0℃时的体积数),即这种气体在水里的溶解度。②将饱和的nano3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
2、饱和溶液和不饱和溶液的判断:
一般说来,可以向原溶液中再加人少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。
3、饱和溶液和不饱和溶液之间的相互转化:
大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体):

但是,由于Ca(OH)2的溶解度在一定范围内随温度的升高而减小,因此将Ca(OH)2的不饱和溶液转化为饱和溶液,在改变温度时应该是升高温度;将熟石灰的饱和溶液转化为不饱和溶液,在改变温度时应该是降低温度。

4、溶解度的含义:
固体的溶解度:在一定温度下某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。如果不说明溶剂通常所说的溶解度是指物质在水里的溶解度。影响因素:①溶质、溶剂的性质;②温度。
气体的溶解度:气体的溶解度是指该种气体在一定压强和一定温度时溶解在1体积水里达到饱和状态时的气体体积(气体的体积要换算成标准状况时的体积)。
影响气体溶解度的因素:内因:气体和水本身的性质。
外因:①温度:随温度升高而减小;②压强:随压强增大而增大。
5、溶解度曲线:
在一定温度下,某固态物质在100g溶剂里达到饱和时所溶解的克数,叫做这种物质在这种溶剂里的溶解度。加溶剂、升温 固体的溶解度:在一定温度下,某固态物质的在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。2.线溶(róng)解(jiě)度(dù)曲线表示某物质在不同温度下的溶(róng)解(jiě)度(dù)或溶(róng)解(jiě)度(dù)随温度的变化情况。
6、溶解度曲线的意义及应用:
①根据溶解度曲线可以查出某温度下该物质的溶解度;也可以查出该物质已知溶解度所对应的温度。曲线上的点即该物质对应温度时的溶解度,按其数据配成的溶液正好为饱和溶液;若按曲线下面的任何一点的数据所配溶液,均为该温度下该物质的不饱和溶液;如按曲线上面任何一点所表示的数据配制溶液,溶液中均含有未溶解的晶体,所配溶液为饱和溶液。
另一方面也与外界条件如温度、压强、溶剂种类等有关.在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同.大部分固体随温度升高溶解度升高,一少部分固体随温度升高溶解度降低,如碳酸钙.。大多数固体物质的溶(róng)解(jiě)度(dù)随温度升高而增大。大部分固体随温度升高溶(róng)解(jiě)度(dù)增大。

③不同物质在同一温度下的溶解度借助不同物质的溶解度曲线,可比较相同温度下各物质溶解的大小。
④几种物质溶解度曲线的交点,表示对应温度下几种物质的溶解度相等。
5、加热水50毫升左右,水温上升到55度-60度,加入2大包药粉,右手用玻棒搅拌,左手拿温度计不时测量温度,溶液温度低于50度初中化学溶解性,就加入少量热水提高温度到50度以上,让药物充分溶解。在一定温度和压强下,气体在一定量溶剂中溶解的最高量称为气体的溶解度.常用定温下1体积溶剂中所溶解的最多体积数来表示.如20℃时100ml水中能溶解1.82ml氢气,则表示为1.82ml/100ml水等.气体的溶解度除与气体本性、溶剂性质有关外,还与温度、压强有关,其溶解度一般随着温度升高而减少,由于气体溶解时体积变化很大,故其溶解度随压强增大而显著增大.关于气体溶解于液体的溶解度,在1803年英国化学家w.亨利,根据对稀溶液的研究总结出一条定律,称为亨利定律.。对于水解度为88的,溶解一定要在没有升温的时候,注入水,把搅拌速度调得高些,再缓慢加入,让其在水中分散开来,再升温,溶解过程不要降低搅拌速度,温度要达到90度,这样就可以溶解完全。
物质溶解的多与少和很多因素有关,如压力、搅拌、温度等,溶解与析出往往是可逆的。另一方面也与外界条件如温度、压强、溶剂种类等有关.在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同.大部分固体随温度升高溶解度升高,一少部分固体随温度升高溶解度降低,如碳酸钙.。而方糖的溶解从本质上与搅拌加快溶解是一致的,只不过它从另外一个角度来说明增加物质与水的接触面(所谓咬碎)可以加快溶解。
2、溶解度曲线既能定性地反映固体的溶解度受温度影响而变化的趋势(溶解度曲线的伸展方向),也能表示某固态物质在某温度下的溶解度,还能用于比较同一温度不同溶质的溶解
3、气体的溶解度受温度和压强的影响。温度一定,气体的溶解度随压强的增大而增大,随压强的减小而减小;压强一定,气体的溶解度随温度的升高而减小,随温度的降低而增大。
4、四点理解溶解度概念:
①一定温度。同一种固体物质在不同温度下对应的溶解度是不同的,因此必须指明温度。
②100g溶剂。此处100 g是指溶剂质量,不能误认为溶液质量。
5、在一定温度下,某物质在 溶剂中达到 状态时所溶解的质量为该物质的在这种溶剂里的溶解度。加溶剂、升温 固体的溶解度:在一定温度下,某固态物质的在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。在一定温度下,某固态物质在100g溶剂里达到饱和时所溶解的克数,叫做这种物质在这种溶剂里的溶解度。

④单位:g[严格地说应该是g/100g(溶剂)]。
5、二角度比较饱和溶液与不饱和溶液:
①首先要明确“一定条件”、“一定量的溶剂”。在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。
②必须明确是某种溶质的饱和溶液或不饱和溶液。如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。
6、根据溶解度曲线可以查出某温度下该物质的溶解度;也可以查出该物质已知溶解度所对应的温度。曲线上的点即该物质对应温度时的溶解度,按其数据配成的溶液正好为饱和溶液;不同物质在同一温度下的溶解度的大小可借助不同物质的溶解度曲线加以比较。几种物质溶解度曲线的交点,表示对应温度下几种物质的溶解度相等。
【典型例题】
例析:
1、右图所示A、B两种固体物质的溶解度曲线,在t2℃时,当A、B两种物质的溶液接近饱和时,下列哪种方法使两溶液都能达到饱和( )
A.降低温度 B.加入溶剂
C.加入溶质 D.倒出一部分溶液

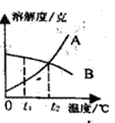
解析:
不饱和溶液转化成饱和溶液的方法要根据溶质的溶解度和温度的关系具体而定,而加溶质可以使任何不饱和溶液变得饱和。根据溶解度曲线可以看出A、B的溶解度随温度变化的趋势不同,因此改变温度一定不能同时使A、B变为饱和;加入溶剂只能使溶液更不饱和;加入溶质可以使A、B都变得饱和;倒出溶液,溶液的不饱和状态不会改变。故选C。
答案:C
2、如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
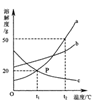
(1)P点的含义是_____________________。
(2)t2℃时30g a物质加入到50g水中不断搅拌,形成的溶液质量是______g。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是________(填写物质序号)。
(4)在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是____________________,所得溶液中溶质质量分数最小的是______________。
解析:
溶解度曲线上的点表示一定温度下该物质的溶解度;由溶解度曲线可知t2℃时a的溶解度为50g,因此50g水中最多可溶解a25g,30ga物质加入到50g水中形成溶液的质量的75g。由溶解度曲线可以看出t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是c、b、a;a物质的溶解度随温度升高变化较大,因此降温时析出晶体最多初中化学溶解性,t2℃时C的溶解度最小,饱和溶液的溶质质量分数最小,降温到t1℃时其溶质质量分数不变,还是最小。
答案:
(1)t1℃时a和c的溶解度均为20g(2)75(3)cba(4)a,c
千总