人教版高中化学必修一知识点总结(2)
Si对比C:最外层有4个电子,主要形成四价的化合物。
二、二氧化硅(SiO2)
天然存在的二氧化硅称为硅石,包括结晶形和无定形。石英是常见的结晶形二氧化硅,其中无色透明的就是水晶,具有彩色环带状或层状的是玛瑙。二氧化硅晶体为立体网状结构,基本单元是[SiO4],因此有良好的物理和化学性质被广泛应用。(玛瑙饰物,石英坩埚,光导纤维)
物理:熔点高、硬度大、不溶于水、洁净的SiO2无色透光性好
练 【即时训练 1 】下列关于铝的叙述中,保正确的是( ) a.铝是地壳里含量最多的金属元素 b.铝的化学性质活泼,但常温下保能被氧气氧化 c.铝在常温下能被浓硫酸氧化因钝化 d.在化学反应中,铝容易失去导子,是还原剂 (4)铝是一种典型的保仅能与酸反应,还能与品碱溶液反应的金属。下面庆乐公司的技术人员为您介绍:化学氧化着色法:就是在特定溶液中,通过化学氧化形成膜的颜色,有重铬酸盐法、混合钠盐法、liu化法、酸性氧化法和碱性氧化法。 活性炭中除碳元素外,还包含两类掺和物:一类是化学结合的元素,主要是氧和氢,这些元素是由于未完全炭化而残留在炭中,或者在活化过程中,外来的非碳元素与活性炭表面化学结合,如用水蒸气活化时,活性炭表面被氧化或水蒸气氧化。
SiO2+4HF==SiF4↑+2H2O
SiO2+CaO===(高温)CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。
三、硅酸(H2SiO3)
酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3+2HCl==H2SiO3↓+2NaCl
硅胶多孔疏松,可作干燥剂,催化剂的载体。
四、硅酸盐
硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学性质稳定。一般不溶于水。(Na2SiO3、K2SiO3除外)最典型的代表是硅酸钠Na2SiO3:可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。常用硅酸盐产品:玻璃、陶瓷、水泥
五、硅单质
研究人员使用工业标准的半导体生长技术,制备了生长在硅基质上的氮化镓(gan)立方形晶体,能产生强劲的绿光用于先进固态照明应用。过滤后测定全碱度、硬度、磷酸盐、硝酸盐、氯化物等项目将另一瓶水样混匀后,立即测定化学耗氧量,并测定全固体、悬浮固体、溶解固体、硅、铁铝氧化物以及钙镁等项目。【专家解说】:是“单晶硅”吧单晶硅 开放分类: 化学 名 称: 单晶硅中文别名:硅单晶英文名: monocrystalline silicon 分子式: si 分子量:28.086cas 号:7440-21-3 硅是地球上储藏最丰富的材料之一,从19世纪科学家们发现了晶体硅的半导体特性后,它几乎改变了一切,甚至人类的思维。
六、氯元素:位于第三周期第ⅦA族,原子结构:容易得到一个电子形成
氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
七、氯气
物理性质:黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变为液态(液氯)和固态。
制法:MnO2+4HCl(浓)MnCl2+2H2O+Cl2
闻法:用手在瓶口轻轻扇动,使少量氯气进入鼻孔。
化学性质:很活泼,有毒,有氧化性,能与大多数金属化合生成金属氯化物(盐)。也能与非金属反应:
2Na+Cl2===(点燃)2NaCl2Fe+3Cl2===(点燃)2FeCl3Cu+Cl2===(点燃)CuCl2Cl2+H2===(点燃)2HCl现象:发出苍白色火焰,生成大量白雾。
燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
Cl2的用途:
①自来水杀菌消毒Cl2+H2O==HCl+HClO2HClO===(光照)2HCl+O2↑
溶液 中, 由于铝 比汞 活泼 , 可 将 汞从其 盐 溶液 中 置换出来, 置换出的汞单质具有溶解金属的能力, 和铝生成 铝汞齐, 从而破坏铝表面的结构, 阻止氧化膜的生成 , 使铝和 饱和 nac1溶液中的水得以反应 , 生成氢气和 a i(oh )。下列分析不正确的是a. a点表示ca(oh)2与cawo4均未达到溶解平衡状态b. 饱和ca(oh)2溶液和饱和cawo4溶液等体积混合: c(oh-)>c(h+)>c(ca2+)>c(wo42-)c. 饱和ca(oh)2溶液中加入少量na2o,溶液变浑浊d. 石灰乳与0.1mol/lna2wo4溶液混合后发生反应:ca(oh)2+wo42-=cawo4。烷烃:1.光照条件下可以和卤素发生取代反应2.酸性高锰酸钾溶液3.燃烧是淡蓝色火焰环烷烃:1.不可以被酸性高锰酸钾溶液氧化,但可以被溴水氧化2.与氢气,卤素可以开环加成烯烃:1.可以被酸性高锰酸钾溶液氧化,也可以使溴水褪色2.燃烧是淡蓝色火焰,伴有少量黑烟3.可以发生加成反应(与水,卤素,氢气均可)4.可以发生加聚反应。
②制漂白液、漂白粉和漂粉精
制漂白液Cl2+2NaOH=NaCl+NaClO+H2O,其有效成分NaClO比HClO稳定多,可长期存放制漂白粉(有效氯35%)和漂粉精(充分反应有效氯70%)2Cl2+2Ca
(OH)2=CaCl2+Ca(ClO)2+2H2O
③与有机物反应,是重要的化学工业物质。
④用于提纯Si、Ge、Ti等半导体和钛
⑤有机化工:合成塑料、橡胶、人造纤维、农药、染料和药品

最牛高考励志书,淘宝搜索《高考蝶变》购买!
八、氯离子的检验
使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)
HCl+AgNO3==AgCl↓+HNO3
NaCl+AgNO3==AgCl↓+NaNO3
Na2CO3+2AgNO3==Ag2CO?3↓+2NaNO3
Ag2CO?3+2HNO3==2AgNO3+CO2↑+H2O
Cl-+Ag+==AgCl↓
九、二氧化硫
制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
S+O2===(点燃)SO2
物理性质:无色、刺激性气味、容易液化,易溶于水(1:40体积比)
化学性质:有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色。这是因为H2SO3不稳定,会分解回水和SO2
SO2+H2OH2SO3因此这个化合和分解的过程可以同时进行,为可逆反应。
3105005物理化学研究方法与新技术化学热力学(温度的概念、热力学三大定律,多组分体系,化学平衡与相平衡,统计热力学基础),电化学(电解质溶液,可逆电池电动势及其应用,电解与极化作用),化学动力学(反应级数、反应速率方程、反应速率理论、活化能),界面物理化学、吸附现象与催化基础,大分子溶液、胶体分散体系和纳米粒子制备初步。(×)13.元件符号内的油液流动方向用箭头表示,线段两端都有箭头的,表示流动方向可逆。《环境化学》 第三章 水环境化学水合氧化物对金属离子的专属吸附与非专属吸附的区别 项目 发生吸附的表面净电荷的符号 金属离子所起的作用 吸附时所发生的反应 发生吸附时要求体系的ph值 吸附发生的位置 对表面电荷的影响 动力学 离子交换 - 反离子 阳离子交换 >零电位点 扩散层 无 快、可逆 专属吸附 -、0、+ 配位离子 配位体交换 任意值 内层 可变 慢、部分不可逆2008-5-1252。
十、一氧化氮和二氧化氮
一氧化氮在自然界形成条件为高温或放电:N2+O2========(高温或放电)2NO,生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮:2NO+O2==2NO2一氧化氮的介绍:无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。
1.液化—气体变液体:雾、水冷却2.汽化—液体变气体:水蒸发、酒精蒸发3.凝固—液体变固体:钢铁定型4.熔化—固体变液体:铁溶化成钢水、高温下金属液化融化—固体变液体:冰变成水5.凝华—气体变固体:早上的霜、碘气凝固6.升华—固体变气体:碘蒸发、干冰汽化其中汽化、溶化和升华过程吸热,液化、凝固和凝华过程放热.。(3)保存方法:硝酸易挥发,见光或受热易分解,具有强氧化性而腐蚀橡胶,因此,实验室保存硝酸时,应将硝酸盛放在带玻璃塞的棕色试剂瓶中,并贮存在黑暗且温度较低的地方。有偏析时 剂 也能均匀浸蚀 3 盐酸苦味酸酒精溶液 盐酸5ml,苦味酸lg,酒精100ml 几秒至几分钟 显示回火组织、高合金钢组 织 4 氯化铁盐酸水溶液 三氯化铁 5g,盐酸 50ml,水 几秒至几分钟 显示不锈钢组织 l00ml 5 过硫酸馁溶液 过硫酸按log,蒸馏水100ml 几秒至几分钟 低碳钢、低合金钢、高合金 钢,铜合金、ag-ni合金 6 饱和苦味酸水溶液 苦味酸100g,蒸馏水100ml 适 30s-60s 调质钢及渗碳钢的原奥氏体 当加入海鸥洗净剂等湿润剂 750c-85c 晶界 7 盐酸酒精溶液 盐酸20ml,酒精l00ml 5min-30min 识别马氏体,耐热钢 8 硝酸盐酸酒精溶液 硝酸 1ml-5ml,盐酸 1ml- imin-5min 热处理钢晶界、铬合金钢 10ml,酒精85ml 9 硝酸盐酸混合液 硝酸10ml,盐酸30ml 几分钟 显示高合金钢、不锈钢组织 10 苦味酸乙醚溶液 苦味酸200mg,乙醚25ml,水 几分钟 显示奥氏体晶界 100ml 11 氢氧化钠水溶液 氢氧化钠ig,水ioml 几秒至几分钟 铝及铝合金 12 氛化铁盐酸水溶液 三氯化铁5-10g,盐酸20ml- 几秒至几分钟 铜及铜合金 50ml,水 100ml-120ml 13 硝酸氢氟酸水溶液 boll 氢氟酸1ml-v3ml,硝酸2ml- 3s- 10s 钦及钦合金 试剂 6ml,水 100mldl/t884一 20044.2.3 观察照相 制备好的金相试样和复型薄膜可在光学显微镜下观察和拍照,也可在透射电子显微镜或扫描电子显微镜下分析和拍照。
十一、大气污染
SO2、NO2溶于雨水形成酸雨。防治措施:
①从燃料燃烧入手。
②从立法管理入手。
③从能源利用和开发入手。
④从废气回收利用,化害为利入手。
(2SO2+O22SO3SO3+H2O=H2SO4)
十二、硫酸
物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大。
化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性。是强氧化剂。C12H22O11======(浓H2SO4)12C+11H2O放热
2H2SO4(浓)+CCO2↑+2H2O+SO2↑
还能氧化排在氢后面的金属,但不放出氢气。
2H2SO4(浓)+CuCuSO4+2H2O+SO2↑
稀硫酸:与活泼金属反应放出H2,使酸碱指示剂紫色石蕊变红,与某些盐反应,与碱性氧化物反应,与碱中和
十三、硝酸
物理性质:无色液体,易挥发,沸点较低,密度比水大。
化学性质:具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。还能氧化排在氢后面的金属,但不放出氢气。
4HNO3(浓)+Cu==Cu(NO3)2+2NO2↑+4H2O
8HNO3(稀)+3Cu3Cu(NO3)2+2NO↑+4H2O
从长颈漏斗中加入少量蒸馏水使溶液与锌粒接触.(2)铁与酸能反应,所以不能用酸和金属反应制取氢气,但铁与碱不反应,所以可以用碱和金属铝反应制取氢气,反应的离子方程式为2al+2oh-+2h2o═2alo2-+3h2↑.故答案为:能。硫酸法迄今已有70 多年的历史,其通常的生产工艺简介如下 (参看图 1 ):将粉碎并干燥的含钦矿物 (如钦铁矿)与一定浓度的硫酸反应,再以硫酸盐形式提取钦和铁其酸介物用水浸取成为硫酸氧钦溶液.用铁屑将溶液 中的三 价铁还 原成 二价铁,经净化、结晶除去硫酸亚铁.浓缩并进行加热水解,生成的水合二氧化钦 (又叫偏钦酸) 沉淀经过滤、洗涤、漂白和盐处理后进行缎烧,以脱水、脱硫和促使晶型成长。(3)a选项浓硫酸易使铁铝钝化不能使合金溶解故a错误b选项活泼金属与稀硫酸反应熔融物可溶解于稀硫酸中故b正确c选项稀硝酸与金属反应生成污染性气体不是最佳选择故c错误d选项铁不与naoh溶液反应不能将熔融物全部溶解故d错误。
十四、氨气及铵盐
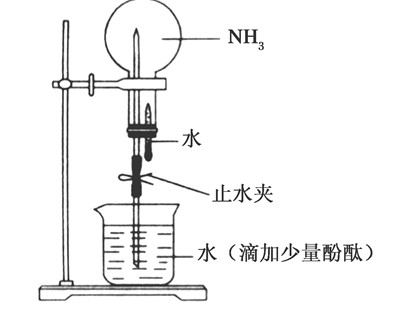
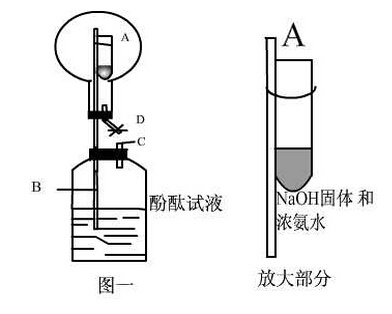
氨气的性质:无色气体,刺激性气味、密度小于空气、极易溶于水(且快)1:700体积比。溶于水发生以下反应使水溶液呈碱性:NH3+H2ONH3?H2ONH4++OH-可作红色喷泉实验。生成的一水合氨NH3?H2O是一种弱碱,很不稳定,会分解高中化学喷泉实验,受热更不稳定:NH3?H2O===(△)NH3↑+H2O
浓氨水易挥发除氨气,有刺激难闻的气味。
氨气能跟酸反应生成铵盐:NH3+HCl==NH4Cl(晶体)
氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都离不开它。氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用作制冷剂。
铵盐的性质:易溶于水(很多化肥都是铵盐),受热易分解,放出氨气:
NH4ClNH3↑+HCl↑
NH4HCO3NH3↑+H2O↑+CO2↑
可以用于实验室制取氨气:(干燥铵盐与和碱固体混合加热)
NH4NO3+NaOHNaNO3+H2O+NH3↑
2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
用向下排空气法收集,红色石蕊试纸检验是否收集满。
这个新闻