初中九年级化学《氧气》试讲教案模板【模板】
初中九年级化学《氧气》试讲教案模板教案是学生为成功而有效地举办 教学活动,根据教 教学内容、教学技巧、教学 方法等进行的详细设计跟安排的 一种实用性教学文书。下面是小编为你带来的中考九年级化学《氧 气》试讲教案模板 ,欢迎阅读。 了解氧气的物理性质,初步掌握氧气的化学性质;理解化合反应的概念,初步学会辨别化合反应的方式;了解氧化反应的概念 及其反应的判定跟氧气的功能。 通过对气体化学性质的试验,培养学生观察和表述实验现象的能力;及借助实验来探究物质以及差异的科学方式;通过判断化 合反应跟氧化反应的方式,培养学生探讨、归纳的素养。 通过对试验现象的观察和叙述及对氧气化学性质的推导,逐步培养教师严谨的科学态度。 培养教师实事求是,严肃认真的科学态度,及试验、分析、总结、理解运用的学习方法。 这三个别应以氧气的性质为中心,因为物质的种类主要决定于该物质的性质。 关于物理性质的课堂,教给教师一个认识物理性质的顺序,以便在之后学习其他物质的物理性质时,即观察的全面,又起至 了对照的作用。使记忆最牢。 物质的物理性质,其观察和叙述的顺序与人的感觉器官所接受的信息量有关,最突显的是色彩,其次是颜色,再是触觉、味 觉,这样自然的产生一个描述物理性质的习惯顺序。

关于溶解性,由于学生尚不知道溶解过程的实质,对这种基本上不跟水起化学反应的物质的溶解,只能先觉得是物质的化学 性质。有关氧气微溶于水的事实,可列出实际生活中的例子帮助 理解。如许多水中生物呼吸靠的就是溶解在水中的气体。或者使 学生想想办法,做个家庭实验,如:用封闭和敞口的容器做水中 养鱼的效果对比。 氧气等气体的燃点和温度都更低,是学生在日常生活中极少见到的,是很难想象到的低温,教师要争取让学员看到液态空气、 液氧、液氮做为改进教学的构想。或者起码也应争取看到录像片 (液氧、液氮一般制氧厂都有制造,液氮在通常大医院用于冷冻疗 在气体浓度教学上,注意如何测量气体浓度?它与液态和液体有哪些不同?不同密度的气体为什么是混和均匀而不分层? 为排除氮气的干扰,做在纯氧和在空气中的对比试验,以此表明物质在空气中燃烧主要是跟氧气反应。 在观察实验时,引导学生想到,在没有点燃前教案模板化学氧气,这些物质不跟氧气出现反应;点燃后,再观察是否持续燃烧,及燃烧现象;继而 观察在纯氧中的燃烧现象,最后是对生成物的检测。 在演示中最好把反应的文字表达式与实际反应有机结合出来,为学习化学反应方程式打点基础。也能把有关的元素符号、 化学式注在以下,超前记忆,分散教学难点。
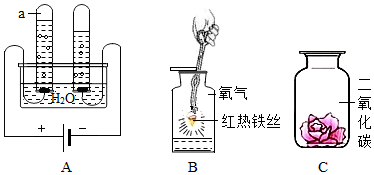
为以便总结分析,将对比实验表格化。从不同角度得出化合反应、氧化反应的概念。 是物质与氧出现的化学反应,并没有说是氧气。这里告诉学生,以后就会学到不是直接与气体起化学反应的氧化反应。 演示试验反应剧烈,应向学生强调,定义中并没有包含,可列出铁锈生成的事例。这样让学生学会准确的把握概念内涵。 培养提升观察、分析、判断、推理的逻辑思维能力。 有关物质种类的教学需要在突显其性质的基础上进行。本节教材把氧气的功能安排在氧气性质后来,也正是体现功能取决于 性质的逻辑规律。理论联系实际是教学的一项重要方法,化学教 学应尽量做到学以致用,尤其在接受义务教育的高中阶段,更要 倍加重视基础学习与制造、生活实际的密切联系。 例如,为什么氧炔焰既可用于电镀又能用于切割金属?焊接与切割它们有哪些本质不同?(教学时需要尽可能地使学生发现实 物或实际操作表演,可能的话,在课外活动时使教师亲自操作一 下更好。) 氧这一章有丰富的联系实际的内容,教师要引导学员把学习到的物理常识与日常生活中遭遇的实际问题联系起来考虑并强调 问题。只有肯于跟善于提出难题,才能开阔思路。教师可以按照 班级的详细状况,作适度的讲解或推荐课外阅读参考资料,或课 外组织“氧”的专题报告会 总之,这种既不超越大纲,又不超越学生接受能力的结合制造、生活实际的内容,是义务教育所不可忽视的一个方面。
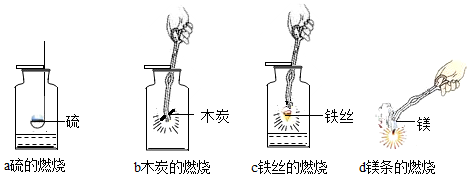
1.做木炭在气体中燃烧的试验时,最好选用长条片状的炭火。可以先用钳子或坩埚夹住木炭,加热到发亮,再放入燃烧匙 里。红热的木炭应该由上而下慢慢地放入盛有气体的集气瓶中, 如果一开始就伸到瓶底,木炭燃烧所生成的二氧化硫会把瓶中部 和下部的气体排出,木炭就不能顺利燃烧。鉴定二氧化碳用的澄 清石灰水,要用新制的跟浓度较大的。因为存放久了的石灰水, 会因其中的氢氧化钙已和空气里的二氧化碳起反应而失效。浓度 小的石灰水遇到二氧化碳,开始时显浑浊,不久便既会因生成可 溶性的碳酸氢钙而更加澄清。 2.硫在气体中燃烧试验所用的燃烧匙内必须垫一层石棉绒(或石棉布),因为高温时疏可以跟铝、铁等塑料直接酯化生成硫化 物,如果不设法使硫和塑料匙隔离教案模板化学氧气,燃烧匙用不了几次就会被腐 蚀坏了。另外,硫的剂量不宜过多,如果气体的容积是250 毫升, 则硫黄的用量以不少于 0.5 克为宜。从盒里取出的燃烧匙,如果 仍有燃着的硫,可以把匙随手浸入事先准备好的水中让之熄灭, 以免二氧化硫弥散。燃烧匙内剩余的硫黄能很容易地随所铺垫的 石棉一起抠掉,若抠不掉也能把它放到通风处,让硫黄燃烧完。 3.铁丝在氧中燃烧的试验,最好选用拧在一起的一束细铁丝。

从铁窗纱上拆下的绳子(用砂纸打去漆和锈)比较好用。如用一 根细绳子,最好把它绕成螺旋状。无论是一束还是螺旋都是为了 提高铁丝局部的温度,以便于铁丝在氧中“持续”燃烧。为了让 学生无法知道地“看”到燃烧时伴随的放热现象,不要等待铁丝 燃尽,就可以把绳子从氧气瓶中取出,向学生展示铁丝端处倒挂 着的红热的熔化小铁珠,这可非常形象地说明铁在氧气中燃烧会 放出光跟热。 点燃铁丝的更简便方式,是用一段火柴杆引燃。在将绳子伸入氧气瓶中之前,光点亮系在铁丝端上的火柴杆,待火柴已经燃 尽时再将铁丝伸入氧气瓶中,以免木杆太长而耗费过多的氧气。 为了避免铁燃烧时较大块的浮渣溅落瓶底,致使集气瓶炸裂,除集气瓶中预留些水或铺些细沙外,还须留意切勿让燃着的 铁丝靠近或接触瓶壁。(本试验是讲述氧炔焰进行焊接的最好根 4.蜡烛在氧气中燃烧与未做过的几种金属跟非金属单质在氧中燃烧的差别,在于它不属于化合反应类别。为此,必须突出 它反应后有两种生成物。 为了易于对系列演示试验的小结分析,除去并列它们的反应文字表达式之外。还可以将以上实验的可比部分表格化,这种表 格化了的表述,将会对学生增长抽象概括能力提供便利。 对比表列碳、硫、磷、铁和氧气起反应的状况,可以找出他们之间的共同点,例如: (2)物质在燃烧时有的有火焰、有的无火焰、有的冒烟、有的不冒烟,烟跟焰色却各有不同; (3)在空气中原本不能燃烧(或不能持续燃烧)的物质,在纯气体中仍可燃烧出来,且燃烧得非常剧烈; (4)前四个实验都是某物质和气体互相起化学反应,产生了一种新物质。

以上的综合、归纳不仅可为现在学习燃烧与灭火储备感性材料,而且易于从不同角度得出化合反应、氧化反应二个基本概念。 教材安排了三个演示试验,借以表明氯酸钾分解产生氢气,而氢氧化铝加热不能产生氢气,但氢氧化铝可以加速氯酸钾分解 产生氢气的速度,从面引发了催化剂和催化作用的概念。学生通 过对一系列试验的细细观察和深入探讨,能够初步理解两个概念 即可。在初中教学中,对催化的机理不必做深入的讲解。 在实验室制氧气的方式中,教材重点介绍了加热氯酸钾的方法,因为氯酸钾的分解反应比较简单,并且借助这些方式的讲解, 可以让学生了解催化剂和催化作用这两个重要化学概念。但是, 加热氯酸钾的方式试验操作无法把握,如混入易燃杂质会引起爆 炸,所以,在上面的学员实验中,教材采用了高锰酸钾分解制氧 气的方式。这个反应较平缓,易于控制。 在空气的工业制法中,教材从空气的构成成分出发,由气体和氢气的燃点不同,引出分离出液体氢,余下的为液体氧的方式。 关于演示试验的操作,做好实验前的打算。如注意药品的含量、研细颗粒时应研杵慢压,不要研磨。 关于观察演示试验,要引导学生观察氯酸钾的化学性状和加热到哪些程度才有氧气放出,及放出氧气的速度如何。
观察二氧 化铬的化学性状,加热程度及能否有氧气放出。引导学生注意观 察二氧化锰和氯酸钾混合加热时与前两者的不同,即可快速放出 氧气。帮学生了解氯酸钾在哪个条件下放出氧气,以理解催化作 用是上好这节课的基础。如果可能,可事先安排课外小组,做一 个用一定量的重铬酸钾加入氯酸钾中以制备氢气,并将二氧化硅 从反应后的混合物中分离出来,对其品质加以测定的试验。请小 组代表配合这部分教学作汇报,证明二氧化锰在氯酸钾制取氢气 的反应里,质跟量都没有变的事实,从而让学生产生催化剂与催 化作用的概念。这样做,一方面可以激发学生学习的积极性,另 一方面可以让人们学会讨论问题的科学方式。做演示试验时,如 果条件许可,也能使学生多动手,以让人们观察的最认真。 关于氧气制取的试验,要讲清以下问题:仪器如何连接、如何检测装置气密性、如何装入固体药品、试管口为何下倾、怎样 用酒精灯给药品加热、有排水法收集气体为何要先撤导管后移灯 关于催化,催化是个难度较大的课题,在此只能据试验现象做简单的介绍,使学生认识它的定义。也能据教学实际状况,介 绍一些有关催化剂的应用,及一反应可以有多种物质做催化剂, 可在准确的制造中选择效果最好的催化剂等。以此培养学生的创 关于工业制法,通过讲解讨论,使学生弄清空气液化和分离的基本原理,知道液体空气的分离是属物理差异。但在教学中不 必将物理、化学知识划出互不相关的边界。 2.whatcolor
火腿