高中化学知识点 金属及其化合物诊断试题【1】(含答案及解析)

下列不能用于鉴别淀粉和纤维素的方法是() a.分别加入碘水,观察颜色 b.分别加稀硫酸煮沸,再加足量naoh溶液调至碱性,加银氨溶液加热观察有无银镜生成 c.分别加热水溶解,观察溶解性 d.放在嘴里咀嚼,有无甜味产生 有机物的分离、提纯、检验(难度系数☆☆) 解析碘单质遇淀粉变蓝色,遇纤维素则无明显现象,a项能鉴别。a.碘单质 b.碘元素c.碘原子d.碘分子(3)下表为某品牌食盐的产品说明,其中“含碘量 (35±15)mg/kg”表示在每千克“加碘盐”中含碘质量为(35±15)毫克,符合国家食盐含碘量的标准。应该是物理吸附吧,也有说发生反应的,碘可能的反应有加成,氧化,取代等用碘蒸气能显色的物质一般是含杂原子、双键、叁键、芳环以及多醇等大多数化合物均能显色.如果不能显色,估计是不含有不饱和基团的烷烃,或者是脂肪酸.。
病因主要有碘与甲状腺癌,放射线与甲状腺癌,促甲状腺激素慢性刺激与甲状腺癌,性激素的作用与甲状腺癌,生甲状腺肿物质与甲状腺癌,其他甲状腺疾病与甲状腺癌,其他甲状腺疾病与甲状腺癌。含碘食物:人体的甲状腺可分泌一种叫甲状腺素的激素,具有产热效应,而甲状腺素由碘和酪氨酸组成。因为海带中含有大量的碘,碘是甲状腺合成的主要物质,如果人体缺少碘,就会患“粗脖子病”,即甲状腺机能减退症,所以,海带是甲状腺机能低下者的最佳食品。

这一病症可用食含碘食盐的方法来预防,这些 内容属于卫生保健的常识性知识。但检验食盐中是否含碘及如何制取碘盐中所需的KIO 生成单质碘,碘遇淀粉变为蓝色。反应的化学方程式为:5KI+KIO 既是氧化产物,又是还原产物,其物质的量之比为51。 本题的第(4)小题是利用电学知识解决化学问题。 依据Q=It 个电子的电量为1.6010-19 =7.47510-2 mol mol22.4Lmol -1 =0.837 【答案】A【解析】 试题分析:氯化铁能溶解铜,反应的化学方程式为2FeCl ,答案选A。考点:考查铁离子的化学性质。 6.下列实验操作与预期实验目的或所得实验结论一致的是 选项 实验操作 实验目的或结论 将NaOH溶液滴入该溶液中加热,放出的气体能 证明溶液中有NH 向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 证明该溶液中存在SO 通入品红溶液中,品红溶液褪色证明Cl 溶液中,溶液变黄色 证明氧化性:H 【答案】A【解析】 试题分析:A、铵盐能与氢氧化钠溶液反应产生碱性气体氨气,氨气能使红色石蕊试纸变蓝 正确;B、向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊,则气体一定是SO ,因此溶液中存在亚硫酸根或亚硫酸氢根,B错误;C、氯 气溶于水生成的次氯酸具有强氧化性,能使品红溶液褪色,C 错误;D、在酸性溶液中硝酸根 也能氧化亚铁离子,则不能判断双氧水与铁离子的氧化性强弱,D 错误,答案选A。
考点:考查实验方案设计与评价 7.下列有关物质的性质、反应现象的描述及其原理解释均正确,且符合因果关系的是 选项 物质的性质或反应现象 原理解释 通入溴水,溴水褪色SO 的性质活泼非金属性:P>N 少量Na投入CuSO 溶液中,Na可以置换出Cu 活泼性:Na>Cu 【答案】B 【解析】 试题分析:A、SO 的还原性,故不正确;B、最高价氧化物对应水化物的碱性高中化学喷泉实验,碱性越强,金属性越强,金属性,Na>Al,故B 正确;C、白磷比氮气性质活泼,不能说明非金属性:P>N,因为氮气中两 个氮原子之间三个共价键,键能大,性质稳定,故 错误;D、Na比较活泼,投入盐溶液中, 先与水反应,生成氢氧化钠溶液,再与硫酸铜反应,故D 错误。 考点:考查金属性、非金属性强弱的比较。 8.有关Na 的叙述中正确的是A.Na 均可与澄清石灰水反应B.NaHCO 热稳定性强C.相同质量的Na 与足量盐酸作用时,产生的气体质量相同D.Na 俗名纯碱,其溶液均显碱性【答案】A 【解析】 试题分析:A.Na 均可与澄清石灰水反应,前者生成碳酸钙和氢氧化钠,后者生成碳酸钙、碳酸钠和水,A 正确;B.Na 热稳定性强,B错误;C.相同质量 的Na 俗名小苏打,其溶液均显碱性高中化学喷泉实验,D错误,答案选 考点:考查碳酸钠和碳酸氢钠性质比较9.下列实验装置正确,且能达到实验目的的是 A.用装置甲进行喷泉实验 B.利用装置乙证明酸性:CH >苯酚C.利用装置丙测定乙醇结构式 D.用装置丁加热熔融NaOH 固体 【答案】C 【解析】 试题分析:A.Cl 在饱和NaCl溶液中溶解度很小,不能形成足够的压强差,因此不能进行喷泉 实验,错误。

B.乙酸的酸性比碳酸强,在广口瓶中会发生反应: 2CH 气体进入到盛有苯酚钠溶液的试管中,发生反应:CH -ONa=CH -OH,因此不能证明酸性:CH 是乙醇,则会与金属Na发生反应产 生氢气,根据产生氢气的多少确定H 原子的种类的多少,若是CH ,则不能发生该反应。因此可利用装置丙测定乙醇结构式,正确。D.由于酒精灯的温度只能达到500,而且 KOH 会与瓷坩埚中的 SiO 在高温下发生反应。所以不能用装置丁加热熔融NaOH 固体,错误。 考点:考查化学实验装置及实验目的的完成情况的正误判断的知识。 10.下列说法正确的是 A.铝合金的密度小,硬度大,可用作建筑材料 B.铜、铝、钠可以分别用热还原法、热分解法和电解冶炼 C.电解从海水中得到的氯化镁溶液可获得金属镁 D.工业上用铝热反应来冶炼铁 【答案】A 【解析】 试题分析:A.铝合金的密度小,硬度大,可用作建筑材料,A 正确;B.铝是活泼的金属, 需要用电解冶炼,工业上主要是电解熔融的氧化铝冶炼金属铝,B 错误;C.镁是活泼的金属, 需要通过电解熔融的氯化镁获得金属镁,C 错误;D.工业上用铝热反应来冶炼难熔的金属或 焊接钢轨,但不能用铝热反应冶炼金属铁,因为不经济,工业上一般用碳或CO 作还原剂冶 炼铁,D 错误,答案选A。
【分析】x能和hcl反应生成气体甲,隔绝空气加热x得到气体甲和固体1,且x和hcl(aq)反应也能得到甲,因此猜测x是碳酸盐,因为x加热易分解且能和酸反应生成co2,那么甲为co2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐。i.取少量滤液于试管中,滴入适量naoh溶液产生白色沉淀至沉淀刚开始溶解,并字不要微热,生成无色刺激性气体,检验该气体的方法是.继续往试管中滴入fecl3溶液,白色沉淀部分转化为红褐色沉淀,则可判断zn(oh)2的kspfe(oh)3的ksp(填“大于”、“小于”、“不能判断”),写出该反应的离子方程式.。②铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程非常大量热量,证明了cu与cucl2溶液反应生成cucl,可以加热观察是否生成白色沉淀,若加热出现沉淀说明cu与cucl2溶液反应生成了cucl,若不出现沉淀说明cu与cucl2溶液不能反应生成了cucl,。
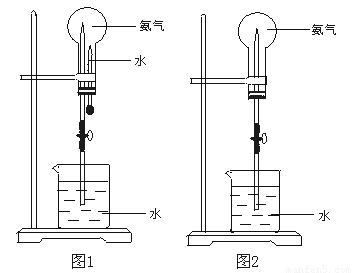
①使用排水法收集的气体较纯净,但缺点是会使收集的气体中禽有水蒸气。硫酸干燥,且能用向上排空法收集,说明气体的密度比空气大,没有尾气吸收装置,说明气体无毒,则a、铜屑和浓硝酸反应生成二氧化氮气体,有毒,应有尾气吸收装置,故a不选。a.排水集气法:适用于收集不溶于水,不与水反应的气体。
有一定量的硫酸剩余,但未能使铜片完全溶解,你认为原因是___________________。 下列药品中能用来证明反应结束后的烧瓶中确有硫酸剩余的是________(填字母)。 a.BaCl 溶液b.银粉 c.Na 溶液【答案】(1)Cu+2H ,防止污染空气;(3)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应;C。 【解析】 试题分析:(1)浓硫酸具有强氧化性,在加热条件下可以和铜发生反应,其反应方程式为: Cu+2H 有毒,尾气必须处理,可以利用SO 的酸性,用碱液吸收,也可以用其还原性,用酸性高锰酸钾溶液吸收;(3)浓硫酸表现氧化性的是+6 价的硫,稀硫酸表现氧化性的是+1 价的氢,随着反应的进行硫酸的浓度 逐渐减小,变成稀硫酸,根据金属活动性,铜排在氢的右边,即铜只跟浓硫酸反应不跟稀硫 酸反应;a、硫酸作用显酸性和氧化性,反应后溶液中有CuSO ,产生干扰,故不行;b、银和硫酸不反应,故错误;c、和酸反应产生气泡,故可行。 考点:考查铜和浓硫酸的反应以及SO 的性质。16.金属冶炼技术随人类对自然界认识的不断深入而发展。下列金属中,最晚实现工业冶炼的 【答案】D【解析】 试题分析:金属越活泼,其金属阳离子获得电子就越难,就越不容易以单质的形式存在,金 属越不活泼,越容易在自然界中以单质形式存在.四种金属的活泼性由弱到强的顺序为:金、 铜、铁、铝;金属越活泼,人类开发利用该金属的时间就越晚.故答案选D。

考点:金属的冶炼方法与使用时间的关系的判断的知识。 17.下列物质中,不能使酸性KMnO 溶液褪色的是乙烯 乙烷 乙苯 乙炔 二氧化硫 甲苯 【答案】C【解析】 试题分析:乙烯含有碳碳双键,乙炔含有碳碳三键,异戊二烯含有2 个碳碳双键,均 能使酸性KMnO 溶液褪色;二氧化硫具有还原性,能使酸性KMnO 溶液褪色,答案选C。 考点:考查有机物性质 18.取m 体的质量增加mg,则下列物质中不能满足上述结果的是 A.CH COOHB.H C.HCOOHD.CO 【答案】C 【解析】 试题分析:2H =2NaOH,有mg 氢气燃烧后,能使过氧化钠增重mg,同理,CO+Na ,同样mgCO燃烧后, 能使过氧化钠增重mg,H 和CO的混合物也能达到固体质量增加mg,A、CH COOH可以拆 写成(CO) ,燃烧后能使固体质量增加mg,故不符合题意;B、依据上述分析,故不符合题意;C、HCOOH 可以拆写成(CO)(H O),燃烧后不能使固体质量增加mg,故符合题意;D、依据上述分析,故不符合题意。 考点:考查过氧化钠的性质等知识。 19.1.76 克铜镁合金完全溶解于50mL、密度为1.40g/cm 、质量分数为63%的浓硝酸中,得到NO 气体1792mL(标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH 液,恰使溶液中的金属离子全部沉淀。
下列说法不正确的是A.该浓硝酸中HNO 的物质的量浓度是14.0mol/LB.加入NaOH 溶液的体积是50mL C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为 0.08mol D.得到的金属氢氧化物的沉淀为3.12 【答案】B【解析】 试题分析:A、该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为 =14.0mol/L,A 正确;B、离子恰好完全沉淀时,此时溶液中溶质为NaNO 根据N元素守恒可知n 0.05L14.0mol/L-1.792L22.4L/mol=0.62mol,根据钠离子守恒有n(NaOH)=n(NaNO =0.62L=620ml,B 错误;C、生成Cu(NO ,体现了浓硝酸的氧化性,起氧化性的硝酸物质的量等于NO 确;D、铜镁合金完全溶解于浓硝酸中,向反应后的溶液中加入NaOH溶液至离子恰好全部 沉淀,生成沉淀为Cu(OH) ,根据电子得失总数Mg和Cu 总物质的量n,2n =0.08mol,n=0.04mol,可求出相等沉淀质量=m(Cu)+m(Mg)+m(OH 1.76g+0.04mol217g/mol=3.12g,B正确,答案选B。
考点:考查化学计算 20.下列叙述中正确的是 Na 都能和水反应生成碱,它们都是碱性氧化物Na 溶液都能跟CaCl 溶液反应得到白色沉淀钠在常温下不容易被氧化 Na 不行除去Na ,将混合物加热至质量不再发生变化可用玻璃棒蘸取 少量待测物质的浓溶液做焰色反应实验 【答案】B【解析】 试题分析:Na 都能和水反应生成碱,其中氧化钠是碱性氧化物,过氧化钠不是,错误;Na 溶液反应得到白色沉淀,碳酸氢钠不能,错误;钠在常温下容易被氧化,错误;Na ,正确;可用铂丝蘸取少量待测物质的浓溶液做焰色反应实验,不能用玻璃棒,错误,答案选B。 考点:考查钠及其化合物性质判断 21.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分 反应后,放出氢气最多的是 A.3 molL -1 HCl B.4 molL -1 HNO C.8molL -1 NaOH D.18 molL -1 【答案】A【解析】 试题分析:本题首先排除D 项,因为Mg 与浓硫酸反应生成SO ,而Al遇浓硫酸钝化;B 两者与硝酸反应生成NO,错误;C项只有铝能发生反应:2Al~3H ;而两则均能与HCl发生反 应:Mg~H ,所以选项为A。
②铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程非常大量热量,证明了cu与cucl2溶液反应生成cucl,可以加热观察是否生成白色沉淀.。【分析】x能和hcl反应生成气体甲,隔绝空气加热x得到气体甲和固体1,且x和hcl(aq)反应也能得到甲,因此猜测x是碳酸盐,因为x加热易分解且能和酸反应生成co2,那么甲为co2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐。且x和hcl(aq)反应也能得到甲,因此猜测x是碳酸盐,因为x加热易分解且能和酸反应生成co2,那么甲为co2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐。
6.蒸发和结晶 蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法.结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物.结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出.加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅.当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离nacl和kno3混合物.。 (3) 用乙醇还原 k2cr2o7 和硫酸的混合溶液得到的含 cr3+ 的溶液的颜色是深暗蓝紫色的, 放臵蒸发水分后能结晶出 kcr(so4).12h2o 紫色八面体晶体,若为加快蒸发水分,将该溶液 加热,溶液颜色变为绿色,冷却后不再产生紫色的铬钒晶体。除铁后净化的氯化钴溶液再用盐酸调节ph为3左右,经过滤、蒸发浓缩、冷却结晶、离心分离得氯化钴晶体。
向美囯佬开炮