药品不良反应报告表填写要求与范例
加强药品不良反应和医疗器械不良事件监测和报告,上半年上报药品不良反应242例,医疗器械不良事件61件。(七)组织机构:各级药品监督管理部门应综合考虑本地区人口数量、经济社会发展水平、药品不良反应报告数、医药企业数、用药水平等因素,合理制订本级药品不良反应监测机构设置标准和要求,建立健全药品不良反应监测机构,开展本行政区域内药品不良反应报告和监测工作。经营企业药品不良反应监测第十章医疗卫生机构在药品不良反应报告和监测中的地位和作用第十一章 《药品不良反应报告和监测管理办法》释义第十二章医疗器械不良事件监测附录。
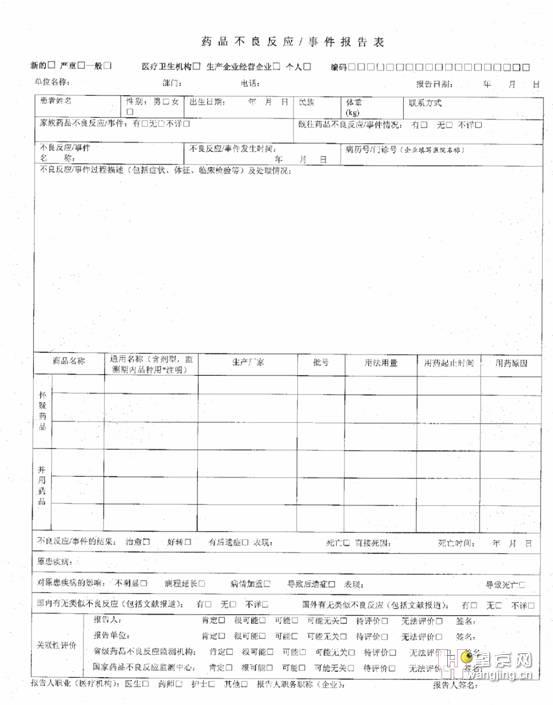
1、 填写注意事项 (1)《办法》 第十四条规定: 《药品不良反应/事件报告表》 的填报内容应真实、 完整、准确。 (2)《药品不良反应/事件报告表》 是药品安全性监测工作的重要档案资料, 手工报表需要长期保存, 因此需用钢笔、 签字笔书写, 填写内容、 签署意见(包括有关人员的签字)字迹要清楚, 不得用报告表中未规定的符号、 代号、 不通用的缩写形式和花体式签名。 其中选择项画“√ ”,叙述项应准确、 完整、 简明药品不良反应填写范例, 不得有缺漏项。 (3) 每一个病人填写一张报告表。 (4) 个人报告建议由专业人员填写, 可以是诊治医务人员、 药品生产、 经营企业专 (兼)职人员及专业监测机构人员。 (5) 尽可能详细地填写报告表中所要求的项目。 有些内容无法获得时, 填写“不详。 (6) 对于报告表中的描述性内容, 如果报告表提供的空间不够, 可另附 A4 纸说明。在纸的顶部注明“附件”, 所有的附件应按顺序标明页码, 附件中必须指出描述项目的名称。 (7) 补充报告: 如需作补充报告时, 请注意与原报表编号保持一致, 并在报告左上方注明“补充报告”, 与原报表重复的部分可不必再填写。
(七)组织机构:各级药品监督管理部门应综合考虑本地区人口数量、经济社会发展水平、药品不良反应报告数、医药企业数、用药水平等因素,合理制订本级药品不良反应监测机构设置标准和要求,建立健全药品不良反应监测机构,开展本行政区域内药品不良反应报告和监测工作。设区的市级、县级药品不良反应监测机构应当对死亡病例进行调查,详细了解死亡病例的基本信息、药品使用情况、不良反应发生及诊治情况等,自收到报告之日起15个工作日内完成调查报告,报同级药品监督管理部门和卫生行政部门,以及上一级药品不良反应监测机构。⑷规范医保、新农合门诊及住院操作,医保和新农合资金是群众的救命钱,一定要按上级规定和方案运作,严明责任纪律,医疗组要把握住院指征,完善病历书写、用药指征,自费药品按规定处理。

单位编码第一位如下填写: 医疗机构 1, 军队医院 2, 计生机构 3, 生产企业 4, 经营企业 5, 个人报告单位编码一栏填写 6000。 (4) 单位名称: 填写医疗卫生机构、 药品生产企业或经营企业的完整全称。 如: 不可填“人民医院”, 应填写“慈溪市人民医院”, “宁波市第一医院”。 (5) 部门: 填写报告单位的具体报告部门, 应填写标准全称或简称, 如:“普通外科二病房” 或“普外二”。 (6) 电话: 填写报告部门的电话, 注意填写区号, 如: 0574-87390403。 (7) 报告日期: 是指不良反应报告填写时间。 (8) 患者姓名: 填写患者真实全名。 ① 当新生儿被发现有出生缺陷时, 如果报告者认为这种出生缺陷可能与孕妇在妊娠期间服用药品有关时,患者是新生儿药品不良反应填写范例, 将母亲使用的可能引起新生儿出现 ADR 的药品列在可疑药品栏目中; ② 如果孕妇在妊娠期间服用药品出现 ADR 没有影响到胎儿/新生儿, 患者是母亲; ③ 如果 ADR 是胎儿死亡或自然流产, 患者是母亲; ④ 如果新生儿和母亲都发生 ADR, 应填写两张报告表, 并且注明两张报告表的相关性。
临床医师在开处方或用药医嘱时,应注意询问患者有无药品不良反应史,告诉患者必须严格按药品说明书服用,如用药后有异常反应,要及时停止用药并向医生咨询。以上计算公式仅为估算,并不代表婴儿出生的实际体重.预测胎儿体重的目的在于要及早发现胎儿发育上存在的问题.一般来说,出生时的实际体重与预测体重会有正负10-15%的误差.比如,出生体重4000克,其误差范围会为400克.也就是说,宝宝体重越大,误差范围也就越大.。四、一经发现可疑药品不良反应需详细记录、调查,按规定要求对典型病例详细填写《药品不良反应/事件报告表》,并按规定报告,严重、罕见的或新的药品不良反应病例,最迟不超过15个工作日,其他的不良反应于30天内上报。
②不良反应/事件名称的选取参考《WHO 药品不良反应术语集》。 (17) 不良反应/事件发生时间: ①填写不良反应/事件发生的确切时间。 ②当一个新生儿被发现有出生缺陷, 不良反应/事件的发生时间就是该新生儿的出生日期。 ③当一个胎儿因为先天缺陷而发生早产或流产时, 不良反应/事件的发生时间就是妊娠终止日期。(18) 病历号/门诊号(企业填写医院名称): ①认真填写患者的病历号(门诊号), 以便于对病历详细资料的查找。 ②企业填写须填写病例发生的医院名称。 (19) 不良反应/事件过程描述及处理情况: ①不良反应/事件开始及变化过程, 均需注明具体时间, 如Ⅹ年Ⅹ月Ⅹ日, 不要用“入院后第Ⅹ天”, “用药后第Ⅹ天等”。 ②填写不良反应/事件表现时, 要明确、 具体, 如为过敏型皮疹, 要填写皮疹的类型、性质、 部位、 面积大小等; 如为心律失常, 要填写何种心律失常; 如为上消化道出血, 有呕血者需估计呕血量的多少等; 严重病例应注意生命体征指标(体温、 血压、 脉搏、 呼吸) 的记录。 ③与可疑不良反应/事件有关的辅助检查结果要尽可能明确填写, 如怀疑某药引起血小板减少症, 应填写病人用药前的血小板计数情况及用药后的变化情况; 如怀疑某药引起药物性肝损害, 应填写用药前后的肝功变化情况, 同时要填写肝炎病毒学检验结果。

所有检查要注明检查日期。 ④填写本次临床上发现的不良反应/事件的处理情况, 主要是针对不良反应/事件而采取的医疗措施, 包括为关联性评价而进行的辅助检验结果, 如补做皮肤试验的情况。 ⑤对与不良反应/事件发生有关的既往史进行简要描述: 1) 高血压、 糖尿病、 肝/肾功能障碍等; 2) 过敏史、 怀孕史、 吸烟史、 饮酒史、 药物滥用史等。 (20)怀疑药品: 报告人认为可能与不良反应/事件发生有关的药品。 如果有四个以上的怀疑药品(含四个), 可另附 A4 纸说明。 (21)药品名称: 同时填写商品名和通用名。 如果没有商品名或者商品名不祥, 统一填写“不详”。 通用名称要填写完整, 不可用简称, 如“氨苄”, “先Ⅴ” 等。 监测期内的药品、 进口药上市 5 年内药品应在通用名称左上角以*注明。 (22)生产厂家: 填写药品生产企业的全称, 不可用简称, 如: “上五”、“白云” 等。 (23)批号: 填写药品包装上的生产批号, 请勿填写产品批准文号。
肌内注射一日剂量不超过6 g,静脉用药一日剂量不超过12 g(舒巴坦一日剂量最高不超过4 g)。首次肝素剂量为0.5~0.7mg/kg,以后每小时补给肝素5~7mg,保持分离器内血液凝血时间二、 低分子肝素 一般选择 60 ~ 80iu/kg ,推荐在治疗前 20 ~ 30 分钟 静脉 注射,无需追加剂量。尽管某些药品的 ddd 与临床用药剂量完全相同,如莫西沙星注射剂和口服剂的与临床用药剂量完全相同,如莫西沙星注射剂和口服剂的 ddd 与临床用药剂量都为与临床用药剂量都为 0.4 g ,但也不能将 ddd 当作是对临床用药剂量的限制。
②如果有四个以上的并用药品(含四个), 可另附 A4 纸说明。 (28)不良反应/事件结果: ①本次不良反应/事件经采取相应的医疗措施后的结果, 不是指原患疾病的后果。 例如患者的不良反应已经痊愈, 后来又死于原患疾病或与不良反应无关的并发症, 此栏应选择 “治愈”。 ②不良反应/事件经治疗后明显减轻, 在填写报告表时尚未痊愈, 选择“好转”。 ③不良反应/事件经治疗后, 未能痊愈而留有后遗症时, 应注明后遗症的表现。 后遗症即永久的或长期的生理机能障碍, 应具体填写其临床表现, 注意不应将恢复期或恢复阶段的某些症状视为后遗症。 ④患者因不良反应/事件导致死亡时, 应填写直接死因和死亡时间。 ⑤对于不良反应/事件结果为有后遗症或死亡的病例, 应附详细资料。 (29)原患疾病: 患者所患的所有疾病。 疾病诊断应填写标准全称, 如急性淋巴细胞白血病, 不能写 ALL。 (30)对原患疾病的影响: 不良反应/事件对原患疾病产生的影响, 依据实际情况选择。 (31)国内有无类似不良反应报道/国外有无类似不良反应报道: 依据实际情况填写。

报告期内,公司与上述关联人实际发生的关联交易额为42,556 万元,未超出预计额度。6.医疗机构实行药品不良反应报告制度,应设立专门机构或专人负责监测和报告工作,注意考察、收集本单位使用药品的质量、疗效和反应,及时通过药品不良反应监测网络报告药品不良反应,发现可能与用药有关的严重不良反应时,必须及时向当地人民政府药品监督管理部门和卫生行政部门报告,同时采取有效措施,防止不良后果扩大,并积极配合有关部门的调查。加强药品不良反应和医疗器械不良事件监测和报告,上半年上报药品不良反应242例,医疗器械不良事件61件。
(37)严重药品不良反应/事件是指有下列情形之一者: ①引起死亡; ②致癌、 致畸、 致出生缺陷; ③对生命有危险并能够导致人体永久的或显著的伤残; ④对器官功能产生永久损伤; ⑤导致住院或住院时间延长。 填表人根据严重不良反应/事件实际情况在五种类型中划√ 选择。 3、 对于新的、 严重的药品不良反应/事件病例报告, 药品生产企业报告要求 (1) 填报《药品不良反应/事件报告表》; (2) 产品质量检验报告; (3) 药品说明书(进口药品还须报送国外药品说明书); (4) 产品注册、 再注册时间, 是否在监测期内(进口药是否为首次获准进口 5 年内); (5) 产品状态(是否是国家基本药物、 国家非处方药、 国家医疗保险药品、 中药保护品种); (6) 国内上年度的销售量和销售范围; (7) 境外使用情况(包括注册国家、 注册时间); (8) 变更情况(药品成分或处方、 质量标准、 生产工艺、 说明书变更情况); (9) 国内外临床安全性研究及有关文献报道情况;(10) 除第(1)、(2) 项以外, 其他项目一年之内如无变更, 可以免报。
(二) 药品群体不良反应/事件报告表 《办法》 第十七条明确规定: 药品生产、 经营企业和医疗卫生机构发现群体不良反应,应立即向所在地的省、 自治区、 直辖市(食品) 药品监督管理局、 卫生厅(局) 以及药品不良反应监测中心报告。 省、 自治区、 直辖市(食品) 药品监督管理局应立即会同同级卫生厅(局) 组织调查核实, 并向国家食品药品监督管理局、 卫生部和国家药品不良反应监测中心报告。 1、 对不同单位报告的要求 (1) 医疗卫生机构报告要求 ①事件描述 1)发生时间 2)地点 3)涉及药品名称 4)发生不良反应的人数 5)药品不良反应/事件主要表现 6)诊治过程 7)转归情况 8)在该地区是否为计划内免疫药品 ②典型病例详细填写《药品不良反应/事件报告表》 ③报告单位、 报告人及联系电话 (2) 药品生产企业报告要求 ①事件发生、 发展、 处理等相关情况 ②药品说明书(进口药品须提供国外说明书) ③质量检验报告 ④是否在监测期内(进口药是否为首次获准进口五年内) ⑤注册、 再注册时间 ⑥药品生产批件 ⑦执行标准 ⑧国内外药品安全性研究情况、 国内外药品不良反应发生情况包括文献报道 ⑨典型病例详细填写《药品不良反应/事件报告表》 ⑩报告单位、 报告人及联系电话 (3) 省、 自治区、 直辖市药品不良反应监测中心报告要求 ①组织填写《药品群体不良反应/事件报告表》 ②整理、 分析收到材料 ③提出关联性评价意见 ④密切关注事件后续发展 ⑤事件过程详细调查报告(事件发生、 发展、 处理、 结果等) 2.《药品群体不良反应/事件报告表》 填写详细要求 (1) 商品名: 填写药品的商品名。
我刚升级了