元素周期表的发现及发展史
研究性学习 元素周期表的发展和演变研究领域: 历史, 化学 指导老师: 付君梅 课题成员: 王璨(组长) 陈思冲 陶俊宏 陈赐 李宜瑾 冯国忠课题班级: 新疆师范大学附属中学高二(4) 班 日期: 2012 年 9 月第一部分: 前言 课题背景: 学习化学有整整两年了, 作为学习化学时刻需要的工具——元素周期表对我们的学习作用非常的大, 为此, 我们准备借研究性学习之机, 研究元素周期表的发展历史和几个世纪以来的演变过程。课题目的和意义: 通过此活动, 使同学们能够进一步了 解元素周期表的历史和用 途, 并对同学们日 后的化学学习 起到帮助( 本次研究注重元素周 期表发展的历史,在元素周 期表的性质上并不做重点)。 课题内容: 通过研究等多种方式了 解化学元素周期表的发展历史和发现元素周期表的人物, 使用大量图片向同学们展示元素周期表的各种形式图, 并知道一些元素的用途和作用。 课题研究方法: 1、 到学校、 家里、 市区图书馆或网上搜索所需资料; 2、 整理资料; 3、 分组汇报、 交流、 讨论、 教师指导; 4、 学生进行总结。 人员安排: 王璨组织、 撰写探究实践报告和负责其它工作;冯国忠, 陈思冲负责查找资料;陈赐, 李宜瑾负责收集、 整理、 筛选所需资料;陶俊宏负责多媒体制作。
e是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )a.a、b、c、d、e b.e、c、d、b、a c.b、a、d、c、e d.c、d、a、b、e5.下列各组顺序的排列不正确的是( )a.离子半径:f->na+>mg2+>al3+ b.热稳定性:hcl>h2s>ph3>ash3c.酸性强弱:h3alo3<h2sio3<h2co3<h3po4 d.溶点:金刚石>na>sio2>co26.某元素原子的质量数为a,它的阴离子xn-核外有x个电子,w克这种元素的原子核内中子数为( )a. b.c. d.7.某主族元素r的最高正价与最低负化合价的代数和为4,由此可以判断( )a.r一定是第四周期元素 b.r一定是Ⅳa族元素c.r的气态氢化物比同周期其他元素气态氢化物稳定d.r气态氢化物化学式为h2r8. 元素x和元素y在周期表中位于相邻的两个周期,x和y两原子核外电子总数之和为19,y原子核内质子数比x多3个,下列叙述正确的是( )a.x和y都是性质活泼的元素,在自然界中只能以化合态存在b.x和y形成的化合物的化学式为y2xc. y的化合物种类比x的化合物种类多d.y能置换酸中氢,放出氢气,但不能置换出盐中的金属9. 运用元素周期律分析下面的推断,其中不正确的是( )。8.有四种短周期元素,它们的结构、性质等信息如下表所述:元素 结构、性质等信息a 是短周期中 除稀有气体外 原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 b b与a同周期,其最高价氧化物的水化物呈两性 c 元素的气态氢化物极易溶于水,可用作制冷剂 d 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 请根据表中信息填写:1 a原子的核外电子排布式为________________________________________________________________________。a 原子基态时最外层电子数是其内层电子总数的 2 倍,b 原子基态时 s 电子数与 p 电子数相等,c 在元素周期表的各元素中电负性最大,d 的基态原子核外有 6 个能级且全部充满电子,e 原子基态时未成对电子数是同周期元素中最多的。
这种情况,他一共找到了五组元素周期表的发现史, 他将其称之 为"三元素族", 即: 锂 3 钠 11 钾 19钙 20 锶 88 钡 137氯 17 溴 35 碘 127硫 16 硒 79 碲 128锰 55 铬 52 铁 562.门捷列夫德米特里· 伊万诺维奇· 门捷列夫生于一八三四年二月 七日俄国西伯利亚的托波尔斯克市。 这个时代, 正是欧洲资本主义迅速发展时期。 生产的飞速发展,不断地对科学技术提出新的要求。 化学也同其它科学一样, 取得了惊人的进展。门捷列夫正是在这样一个时代, 诞生到人间。 门捷列夫从小就热爱劳动, 热爱学习。 他认为只有劳动, 才能使人们得到快乐、 美满的生活。 只有学习, 才能使人变得聪明。他不分昼夜地研究着, 探求元素的化学特性和它们的一般的原子特性, 然后将每个元素记在一张小纸卡上。 他企图在元素全部的复杂的特性里, 捕捉元素的共同性。 但他的研究, 一次又一次地失败了 。 可他不屈服, 不灰心, 坚持干下去。在一八六九年二月十九日, 他终于发现了 元素周期律。 他的周期律说明: 简单物体的性质, 以及元素化合物的形式和性质, 都和元素原子量的大小有周期性的依赖关系。

它与物质之间是组成关系,也就是,它是用来描述物质的宏观组成的,习惯上用“组成”来描述.例如,水是由氢元素和氧元素组成的(但不能说“水是由二个氢元素和一个氧元素组成的”).而分子、原子和离子都是微观粒子。毕节铂铑块回收>>工艺分类:铂,又称白金,周期表中第Ⅷ族铂元素,锡白色金属,原子序数为78,相对原子质量为195.09,密度为21.45g/cm,熔点为1769℃,沸点为3800℃。下列说法正确的是()x y z w a.元素w位于第三周期第Ⅵa族b.元素y的氢化物水溶液呈酸性c.最高价氧化物对应的水化物的酸性:z>wd.z的最高化合价为+5价【解析】根据四种短周期元素在周期表中的位置关系可知x、y在第二周期,z、w在第三周期,z元素原子核外电子总数是其最外层电子数的3倍,则z是p,y是n,x是c,w是s。
1843 年盖墨林把当时己知的化学元素按性质相似分类制成了元素表。 十八世纪 六十年代法人尚古多制出了元素分类的螺旋线图或地螺柱图。 他最先提出元素性质和原子量之间有关系, 并初步提出了元素性质的周期性。 螺旋图是向揭示周期律迈出了 有力的第一步, 但缺乏精确性。 1864 年英人欧德林用 46 种元素排出了《元素表》 。 同年德人迈尔依原子量大小排出《六元素》 表。 该表对元素进行了分族, 有了周期的雏型。1865 年英人纽兰兹把 62 种元素依原子量递增顺序排表, 发现每第八个元素性质与第一个元素性质相近, 好似音乐中的八度音, 他称为“ 八音律” 。 八音律揭示了 元素化学性质的重要特征, 但未能揭示出事物内在的规律性。2 . 周期律的发现 化学家绝不满意元素漫无秩序的状态。 从《三素组》 到《八音律》 , 逐步对元素知识进行归纳和总结, 试图从中找出视律性的东西, 为发现周期律开辟了道路。 由于科学资料积累, 元素数目 增多, 终于在十九世纪后半期迈尔和门捷列夫同时发现了元素周期律。 1867 年俄人门捷列夫对当时已发现的 63 种元素进行归纳、 比较, 结果发现: 元素及其化合物的性质是原子量的周期函数的关系, 这就是元素周期律。
依据周期律排出了周期表, 根据周期表, 他修改了 铍、 铯原子量, 预言了三种新元素, 后来陆续被发现, 从而验证了门氏周期律的正确性, 迅速被化学家所接受。 在周期律的指导下, 先后发现了稼、 钪、 锗、 钋、 镭、 锕、镤、 铼、 锝、 钫、 砹等十一种元素同时还预言了稀有气体的存在, 并于 1898 年以后, 陆续发现了氖、 氢、 氙等元素, 因而在周期表中增加ⅧA 族。 到 1944 年自然界存在的 92 种元素全部被发现。 如果说, 原子一一分子论的建立是对化学的一次总结, 那么周期律的发现, 使元素成了一个严整的自然体系, 化学变成一门系统的科学, 它是化学史上的一个重要里程碑它讨原子结构、 有机化学、 原子能、 地球化学、 生物化学、 冶金、新元素的发现与合成都有深远的影响。 为了纪念门氏的伟大发现, 科学家把 101号元素命名为钔。 恩格斯曾给以高度评价: “ 门捷列夫不自 觉地应用黑格尔的量转化为质的规律, 完成了科学上的一个勋业。 ”由于时代的局限性, 门氏不可能认识到周期律更本质的规律。 因此可以说门氏只是原子体系的哥白尼, 而原子体系的伽利略和牛顿, 自有后来人。

这就使晶界结构偏离理想重合位置点阵模型的原子排列,而由若干原子规则排列的单元周期分布在不规则排列的原子中,这些单元为有限的几种原子紧密排列的多面体。原子核外电子的排布元素周期表的发现史,从第二周期开始,每一周期元素原子的电子组态的前面部分正好与前一周期最后一个稀有气体元素原子的电子排布式相同,这部分常称之为原子实,即除去填有电子的最高能级组后,剩下的那部分原子实体,其符号用对应的稀有气体的元素符号加一个方括号来表示。核科技信息2015年,能源部对材料的纳米组合(一个原子接一个原子的排列)研究将创造出可预知性... 将射线探测器3沿检测平面匀均地从扫描宽度的一侧平移到另一侧,在此运程中,射线探...。
要注重基础知识的教学,对重要的化学概念(如:分子、原子、元素等)、化学用语(如:化合价、化学式、离子符号、等)和基本的化学思想方法(如:组成决定性质。道尔顿的原子模型 英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型.虽然,经过后人证实,这是一个失败的理论模型,但,道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”.葡萄干布。(3)理论得到的电子排布必须经过光谱实验来检验其正确与否,事实证明对绝大部分原子,电子排布原理都是适用的,理论得到的电子排布式与实验结果是一致的,但也有少数原子是不符合这些原理的,理论得到的电子排布式与实验结果是不同的,如41号铌(nb)元素、45号铑(rh)元素、46号钯(pd)元素等。
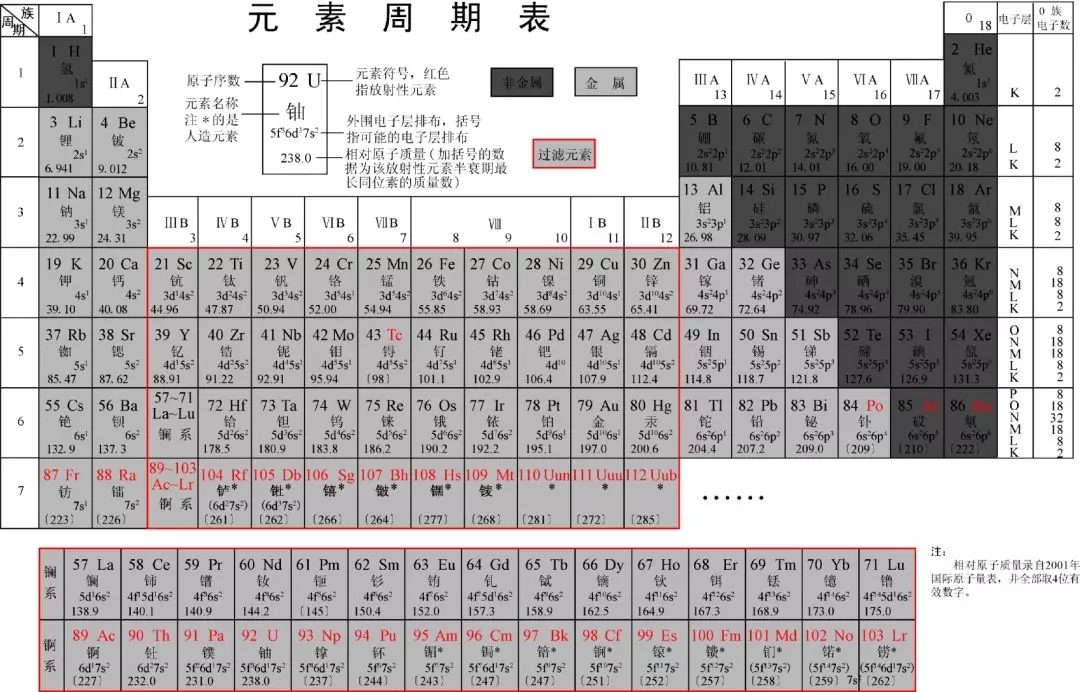
遵循周期律, 把众多的元素(106 种) 组织在一起所形成的系统, 称做化学元素周期系。 周期系的具体形式是各式各样的周期表。 如塔式表、 三分族元素周期表环形、 螺旋形、 扇形、 蜗牛形, 对角形、 带形、 立体支架形、 阶梯形、 罗盘形、 园筒式等五花八门, 各具特色。 但其中最常用的是短表和长表。 近年来, 由 于人工合成元素增多, 长表的优越性日益显露出来, 短表已经完成了 历史使命, 更多的应用让位于长表。 长表的重要特点之一是能够很好的把元素分成元素群, 便于按群体性质来掌握化学元素的总体知识。 表中明显的划分出活泼金属、 非金属、 过渡元素、 低熔合金、 镧系、 锕系元素区。 根据电子构型可分成 S 区、 p 区、d 区、 f 区四组。 便于人们从结构观点去分析比较。 四、 元素周期表简介门捷列夫(Dmitri Mendeleev)将当时已知的 63 种元素依原子量大小并以表的形式排列, 把有相似化学性质的元素放在同一行, 就是元素周期表的雏形。 利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、 钪、锗)。 1913 年英国科学家莫色勒利用阴极射线撞击金属产生 X 射线, 发现原子序越大, X 射线的频率就越高, 因此他认为核的正电荷决定了元素的化学性质, 并把元素依照核内正电荷(即质子数或原子序)排列.后来又经过多名科学家多年的修订才形成当代的周期表。

元素周期表中共有 118 种元素。 将元素按照相对原子质量有小到大依次排列, 并将化学性质相似的元素放在一个纵列。 每一种元素都有一个编号, 大小恰好等于该元素原子的核内质子数目 ,这个编号称为原子序数。 在周期表中, 元素是以元素的原子序排列, 最小的排行最先。 表中一横行称为一个周期, 一列称为一个族. 原子的核外电子排布和性质有明显的规律性, 科学家们是按原子序数递增排列, 将电子层数相同的元素放在同一行, 将最外层电子数相同的元素放在同一列。 元素周期表有 7 个周期, 16 个族。 每一个横行叫作一个周期, 每一个纵行叫作一个族。 这 7 个周期又可分成短周期(1、 2、 3)、 长周期(4、 5、 6) 和不完全周期(7)。共 有 16 个族, 又分为 7 个主族(Ⅰ A -ⅦA ), 7 个副族(Ⅰ B -ⅦB ),一个第Ⅷ族, 一个零族。元素在周期表中的位置不仅反映了元素的原子结构, 也显示了元素性质的递变规律和元素之间的内在联系。 使其构成了 一个完整的体系称为化学发展的重要里程碑之一。同一周期内, 从左到右, 元素核外电子层数相同, 最外层电子数依次递增,原子半径递减(零族元素除外)。
10万元存银行一年缩水100元