关于氨的喷泉实验说法正确的是 A. 证明氨气极易溶于水反应生

Ⅰ.氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质.

请回答:
(1)实验室制取氨气的化学方程式是.
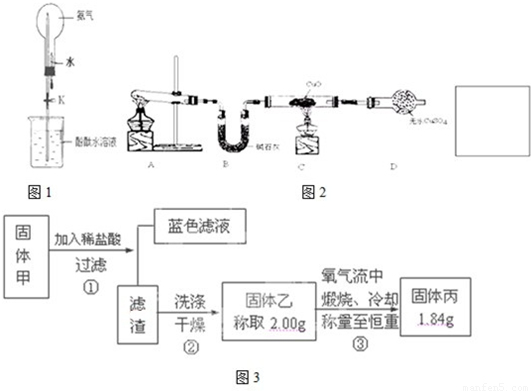
(2)①如图1是进行氨气喷泉实验的装置,引发喷泉的操作步骤是
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
.
②氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示).
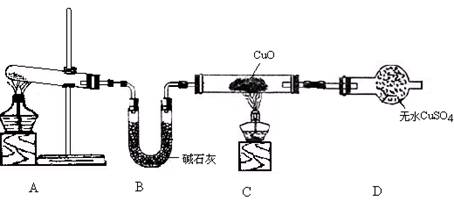
(3)该小组同学设计了图2所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
3CuO+2NH3
3Cu+N2+3H2O
3CuO+2NH3
3Cu+N2+3H2O
.
②碱石灰的作用是
吸收氨气中混有的水蒸气高中化学喷泉实验,防止干扰产物水的测定
吸收氨气中混有的水蒸气,防止干扰产物水的测定

.
③整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)


.
Ⅱ.3.2gCu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为amol,则:①此时溶液中所含的NO3-为
0.1+a
0.1+a
mol.
②所生成的NO在标准状况下体积为
(0.02-0.5a)×22.4
(0.02-0.5a)×22.4
L.(以上结果均用含a的代数式表示)
Ⅲ.某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料知道:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸.在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图3所示的实验:
(1)③中在煅烧过程中一定发生的反应的化学方程式为
2CuS+3O2

高温
2CuO+2SO2
2CuS+3O2
高温
2CuO+2SO2
.
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S.
(18分)
Ⅰ. 氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。
请回答:
(1)实验室制取氨气的化学方程式是。
(2)① 如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是。

② 氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。

(3)1mol h2s气体完全燃烧生成固态硫磺及气态水,释放a kj能量,2mol h2s气体完全燃烧生成固态硫磺及气态水,释放2akj能量,放热,△h<0高中化学喷泉实验,所以其热化学方程式为2h2s(g)+o2(g)=2s(s)+2h2o(g)△h=﹣2akj/mol,。下列做法有利于生态环境保护的是a.焚烧落叶,减少垃圾的运输量b.大力植树造林,增加植被面积c.为增加节日气氛大量燃放烟花爆竹 d.大量使用农药和化肥,增加农作物产量2.下列变化属于化学变化的是a.冰雪融化b.分离液态空气制氧气c.石蜡熔化d.酒精燃烧3.下列化学仪器对应的名称书写正确的是a.长劲漏斗b.量桶c.坩埚钳d.椎形瓶4.下列有关实验现象的描述中,正确的是a.加热试管内的碱式碳酸铜,绿色粉末逐渐变黑,试管口有小水滴b.细铁丝在氧气中燃烧,火星四射,生成红棕色固体c.镁条在空气中燃烧,产生黑烟,生成黑色粉末d.红磷在空气中燃烧产生大量白色烟雾5.溶液的知识广泛用于生产、生活。co32- 加入硝酸钡溶液,生成白色沉淀,该沉淀可溶于硝酸(或盐酸),并生成无色无味、能使澄清石灰水变浑浊的气体(co2)。
② 碱石灰的作用是。
③ 整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。

Ⅱ. 3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为mol。
②所生成的NO在标准状况下体积为 L。(以上结果均用含a的代数式表示)
Ⅲ. 某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
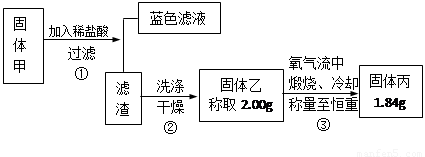
(1)③中在煅烧过程中一定发生的反应的化学方程式为。
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S。
Ⅰ.氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质.
请回答:

(1)实验室制取氨气的化学方程式是 .
(2)①如图1是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 .
②氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) .
(3)该小组同学设计了图2所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式 .
②碱石灰的作用是 .
③整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称) .
Ⅱ.3.2gCu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为amol,则:①此时溶液中所含的NO3-为 mol.
②所生成的NO在标准状况下体积为 L.(以上结果均用含a的代数式表示)
Ⅲ.某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料知道:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸.在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图3所示的实验:
(1)③中在煅烧过程中一定发生的反应的化学方程式为 .
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S.
这是亮剑精神