人教版高中化学必修一教案-2.2 离子反应 《离子反应及其发生的条件》

(4)agno3溶液和氨水 当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有h+、nh4+、mg2+、al3+的混合溶液中逐滴加入naoh溶液,naoh先与h+反应,再与mg2+、al3+反应生成沉淀,再与nh4+反应,最后才溶解al(oh)3沉淀。下列对此现象说法正确的是() a.反应后溶液中不存在任何沉淀,所以反应前后 cu 2+ 的浓度不变 b.在[cu(nh 3 ) 4 ] 2+ 离子中,cu 2+ 给出孤对电子,nh 3 提供空轨道 c.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象d.沉淀溶解后,将生成深蓝色的配合离子[cu(nh 3 ) 4 ] 2+ 6.下列说法正确的是(n a 为阿伏加德罗常数) () a.1molp 4 含有 p&mdash。(10)cu2+ 蓝色水溶液(浓的cucl2溶液显绿色),能与naoh溶液反应,生成蓝色的cu(oh)2沉淀,加热后可转变为黑色的 cuo沉淀.含cu2+溶液能与fe、zn片等反应,在金属片上有红色的铜生成.。
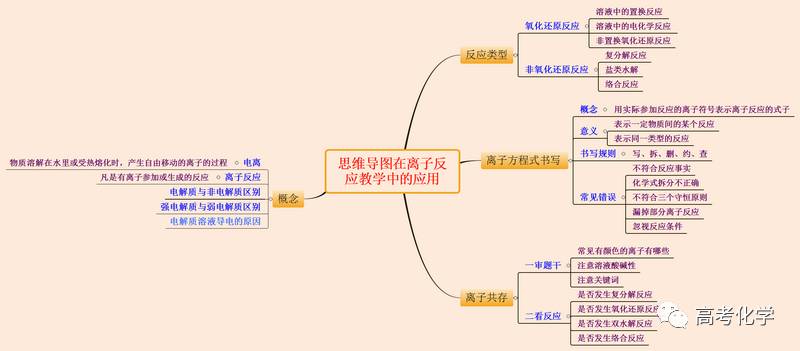
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示。(2)“拆”:把易溶且易电离的物质拆写成离子形式,凡是难溶、难电离,以及气体物质均写成化学式.。2.在书写电离方程式时,可以联系着溶解现象与溶解原理、物质的电离、溶液的导电性及其原理分析、化学式和离子符号的书写、化学符号及其周围数字的意义等相关知识,来理解、分析和书写即可.其中,最关键的是从化学式的哪个地方电离开来,产生相应的阴、阳离子。

Ba2++SO42-===BaSO4↓④“查”――检查方程式两边各元素、原子个数和电荷数是否守恒,离子方程式两边的系数是否为最简比。[小结]四步中离子反应及其发生的条件 教案,“写”是基础,“拆”是关键,“删”是途径,“查”是保证。既然拆是关键,拆时应注意作出准确判断,易溶、易电离物质应拆,难溶、难电离物质仍保留化学式。[点击试题]完成下列反应的离子方程式。①HCl+NaOH ② HCl+KOH ③ NaOH + H2SO4 ④ H2SO4+KOH[投影小结]化学方程式离子方程式NaOH +HCl ==NaCl +H2OKOH +HCl ==KCl +H2O2NaOH + H2SO4 ==Na2SO4 +2H2O2KOH + H2SO4 ==K2SO4 +2H2OH+ + OH-==H2OH+ + OH- ==H2OH+ + OH- ==H2OH+ + OH- ==H2O[设问]通过这些离子方程式你们发现了什么?[分析]反应物不同,却都可用同一离子方程式表示。[小结]可见离子方程式与化学方程式的意义不一样,化学方程式仅代表某一个反应的情况,而离子方程式不仅可表示一定物质间的某一个反应,而且表示所有同一类型的反应。

[板书]2. 离子方程式的意义①揭示反应的实质。②不仅表示一定物质间的某一个反应,而且表示所有同一类型的反应。[设问]是否所有的中和反应的离子方程式都可表示为:H++OH-=====H2O[点击试题]完成下列反应的离子方程式:①Cu(OH)2+HCl ②CH3COOH+KOH ③Ba(OH)2+H2SO4[讲解]上述三个反应的离子方程式分别为:Cu(OH)2+2H+=====Cu2++2H2O (Cu(OH)2——难溶碱)CH3COOH+OH-=====CH3COO-+H2O (CH3COOH——难电离物)Ba2++2OH-+2H++SO42- =====BaSO4↓+2H2O[引导]通过上述比较可知,H++OH-=====H2O这一离子方程式表示的是什么样的中和反应?[小结]H++OH-=====H2O表示强酸+强碱生成可溶性盐+水的这一类反应的本质。[学生实验]实验2-3现象及离子方程式1、向盛有2 mL Na2SO4 溶液的试管里加入2 mL BaCl有白色沉淀2 溶液SO42- + Ba2+ ==BaSO4 ↓2、向盛有2 mL NaOH 稀溶液的试管里滴入几滴酚酞溶液,再用滴管向试管里慢慢滴入稀盐酸,至溶液恰好变色为止溶液变红,又逐渐褪去H+ + OH- ==H2O3、向盛有2 mL Na2CO3 溶液的试管里加入2 mL盐酸有气泡产生CO32-+2H+ ==H2O +CO2[提问]上述离子反应发生后离子反应及其发生的条件 教案,溶液中各离子的数目有何变化?(总有离子的减少)[归纳]离子反应的实质就是通过反应使某些离子的数目明显减少的过程。

溶解性口诀五钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵溶解性口诀六钾钠铵硝溶强溶弱不溶溶解性口诀七:碱溶钾钠钡钙钾钠铵硝全溶碳酸盐溶钾钠铵盐酸盐除银不溶硫酸盐除钡银不溶特例:1.高氯酸的钾。被提纯物质不与酸或碱反应,而杂质可与酸或碱发生反应,可用酸或碱作除杂试剂。酸和碱是初中阶段要求的基于物质类别认识的物质,因此,在义务教育化学课程后期,学生对二氧化碳性质的认识不会局限在二氧化碳与氢氧化钠或氢氧化钙的一两个反应中,可能发展到二氧化碳能与碱这一类物质发生反应,不过不要求判断反应产物。
很多轻型航母