用如图所示的装置做喷泉实验.该实验条件下的气体摩尔体积为a

丙烯酸的结构简式为CH2=CH-COOH,对其性质的描述不正确的是()
A、能与金属钠反应放出氢气
B、能发生加聚反应生成高分子化合物
C、能与新制氢氧化铜反应
D、能与溴水发生氧化反应使其褪色
(2)有一根细而均匀的中空柱状导电材料样品如图a所示,截面为同心圆环如图b所示,在样品两端面上有焊接良好的引出导线.样品长约5cm,教师用多用电表的欧姆挡预测电阻时,选择开关置于“×10”倍率挡,其示数如图c所示,已知这种材料的电阻率为ρ,因该样品的内径太小,无法直接用长度测量工具测量.现提供下列实验器材:。且x和hcl(aq)反应也能得到甲,因此猜测x是碳酸盐,因为x加热易分解且能和酸反应生成co2,那么甲为co2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐。【分析】x能和hcl反应生成气体甲,隔绝空气加热x得到气体甲和固体1,且x和hcl(aq)反应也能得到甲,因此猜测x是碳酸盐,因为x加热易分解且能和酸反应生成co2,那么甲为co2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐。
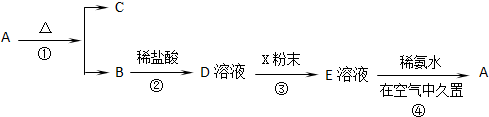
(1)物质A的化学式为;物质B的俗名是,
(2)按要求写出下列转化过程的反应方程式:
A→B+C:;W不稳定,原因是:;
(3)有一瓶存放时间较长的E溶液,某学生怀疑其有部分因氧化而变质,请你设计1个检验它是否变质的实验方案:;如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质?.

 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条看不到明显现象;关闭B阀后,C处红布逐渐褪色.则D瓶中装的是()
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条看不到明显现象;关闭B阀后,C处红布逐渐褪色.则D瓶中装的是()
B、NaOH溶液
25℃CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5mol/L,则CaCO3在该温度下的Ksp为()
A、9.3×10-5mol/L
类似于水的离子积,难溶盐AmBn也有离子积Ksp,且Ksp=[c(An+)]m?[c(Bm-)]n,已知常温下BaSO4的溶解度为2.33×10-4g,则其Ksp为()
某化学兴趣小组的同学在教师的指导下,正确完成如下图所示的两实验.已知所用实验装置气密性良好.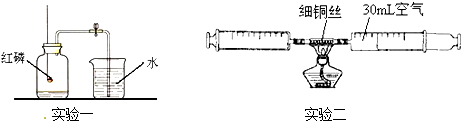
关于该实验有如下说法:①红磷熄灭并冷却后才能打开弹簧夹;②点燃酒精灯加热铜丝,可观察到铜丝由红色变成黑色;③停止加热后即可读出注射器内气体体积约为24mL;④实验取用铜丝的多少不会影响实验结果;⑤两个实验均能证明空气是混合物;⑥两个实验均能证明空气中约含1/5体积的氧气.
其中正确说法的个数有()
A、2个
B、3个
C、4个

D、5个
 现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.
现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B原子L层有2个未成对电子
C元素原子的核外p电子数比s电子数少1
D元素最外层电子数是电子层数的3倍
d和e原子的第一至第四电离能如下表所示:电离能/kj·mol-1 i1 i2 i3 i4 d 738 1 451 7 733 10 540 e 578 1 817 2 745 11 578 (1)a、b、c三种元素的电负性最大的是________(填写元素符号),d、e两元素中d的第一电离能较大的原因是_______________________________________________。非导电靶材,形成恒定的电离电流,气体被击穿,发射电子轰击气体分子高中化学喷泉实验,将靶材中的原子驱除出表面,继续电离其他气体分子,一般是阴极加负高压,使之电离,而不是电子加速撞击,可能还需要直流电弧电源或脉冲电弧电源。这类辐射之所以被称为“电离辐射”,主要是因为电离辐射的射线在遇到其他原子之后,可以通过牺牲自身能量的方式让原子中的电子脱离原子核的束缚,形成自由电子,这也就是物理学中的电离现象。
F是前四周期中电负性最小的元素
G原子核外M层全充满,N层只有1个电子
(1)已知CA5为离子化合物,写出其电子式.
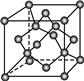
(2)图为B元素的某种单质晶体X的晶胞,其中含有个B原子.

(3)C基态原子中能量最高的电子,其原子轨道呈形.
6.在乙烯分子中有5个σ键、1个π键,它们分别是()a.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键b.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键c.c—h之间是sp2形成的σ键,c—c之间是未参加杂化的2p轨道形成的π键d.c—c之间是sp2形成的σ键,c—h之间是未参加杂化的2p轨道形成的π键解析:选a乙烯分子中,每个c原子都采用sp2杂化方式,每个c原子上各有3个sp2杂化轨道和未杂化的2p轨道,其中3个sp2杂化轨道中,1个用于与另一个c原子形成c—c σ键,2个用于与2个h原子形成c—h σ键,未参与杂化的2p轨道“肩并肩”重叠形成c—c π键。* * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * 某烃有两种或两种以上的同分异构体,其中一种烃的一氯代物只有一种,则这种烃可能是() ①分子中含7个碳原子的芳香烃 ②分子中含4个碳原子的烷烃 ③分子中含6个碳原子的单烯烃 ④分子中含8个碳原子的烷烃 a.③④b.②③ c.①②d.②④ [模型示例] [分析建模] 书写有机物的同分异构体时要按一定的顺序,避免遗漏和重复,一般的思路为类别异构→碳链异构→位置异构。4.氨气分子空间构型是三角锥形,而甲烷分子是正四面体,这是因为()a.两种分子的中心原子的杂化轨道类型不同,nh3为sp2型杂化,而ch4是sp3型杂化b.nh3分子中氮原子形成3个杂化轨道,ch4分子中碳原子形成4个杂化轨道c.nh3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强d.氨气分子是极性分子而甲烷是非极性分子解析:选cnh3和ch4的中心原子都是sp3杂化,故a、b错误。
吸收 发射 原子 光谱分析 举例说明光谱分析的应用: 科学家们通过太阳光谱的分析发现了稀有气体氦,化学研究中利用光谱分析检测一些物质的存在与含量等 高中化学:第一章第一节《原子结构》课件:ppt(人教版选修3) 第一章 物质结构与性质 第一节 原子结构 1、进一步认识原子核外电子的分层排布 2、知道原子核外电子的能层分布及其能量关系 3、知道原子核外电子的能级分布及其能量关系 4、能用符号表示原子核外的不同能级,初步知道量子数的涵义 5、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 6、能用电子排布式表示、简化电子排步式常见元素(1~36号)原子核外电子的排布 学习目标 背景知识回顾 1、。5.原子结构和元素周期系:微观粒子的波粒二象性,波函数,概率密度,电子云,四个量子数(主量子数,角量子数,磁量子数,自旋量子数),原子轨道和电子云的图象,鲍林近似能级图,屏蔽效应,cotton原子轨道能级图,电子填充顺序,核外电子排布原则(能量最低原理,泡利不相容原理,洪特规则),核外电子排布的表示方式(电子排布式,轨道图,量子数表示法),周期表中各元素的电子层结构,原子的电子层结构与元素周期系的关系,周期表的5个区,有效电荷、原子半径、电离能、电子亲和能及电负性的周期性变化。【典型例题】a.电子的能量越低,运动区域离核越远b.当m层是最外层时,最多可排布18个电子c.稀有气体元素原子的最外层都排有8个电子d.核外电子的分层排布即是核外电子的分层运动【答案】d考点:核外电子排布【点评】高中化学必修部分对核外电子排布规律要求比较基础,掌握电子排布的基本规律和前20号元素原子的电子排布,能画出1~18号元素的原子结构示意图即可。
(6)检验F元素的方法是,请用原子结构的知识解释产生此现象的原因是.
下面的实验,读者也可以去试一试:把1 ml~2 ml从鸡蛋里取出的蛋清放进试管里,用水只稀释5~10倍,当逐滴加入硫酸铜的浓溶液时(不必饱和),你会发现这样的现象:生成白色沉淀的现象非常明显,但是当滴入过量硫酸铜溶液时,沉淀会逐渐溶解使溶液变的澄清。12h2o,将明矾溶于水得到明矾溶液,向明矾溶液中加入过量氨水得到al(oh)3,al(oh)3溶于稀硫酸得到al2(so4)3,将al2(so4)3溶液蒸干得到al2(so4)3晶体。实施例3称取双氯芬酸钾100克,加适量蒸馏水溶解,逐加入丙二醇1000克,乙醇4000克,混合后,加入新解蒸馏水至14700克,加入卡波姆200克,滴加三乙醇胺溶液适量,调ph7-8高中化学喷泉实验,交联完成后,呈均匀透明状,分装,即得。
海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在.有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
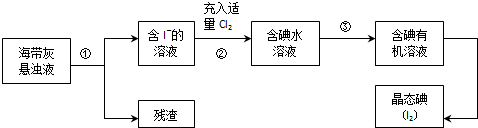
(1)灼烧海带时需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯B.坩埚C.表面皿D.铁架台(带铁圈)E.酒精灯 F.干燥器G.泥三角
(2)指出提取碘的过程中有关的实验操作名称:①,③.
(3)过程②中充入适量Cl2的目的是,反应的离子方程式为.

(4)操作③中所用的有机试剂可以是(只填一种),简述选择其理由.
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是:;
b.最后碘的有机溶液是通过获得(填“漏斗上口”或“漏斗下口”).
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:.
难道我们要倒退到公元前的文明