太阳能电池板材料除单晶硅外.还有铜.铟.镓.硒等化学物质.(

分析 (1)Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布图;
(2)As、Se、Br同属第四周期元素,电离能从左到右逐渐增大,失去第1个电子后,价电子层的P能级上分别是4P2、4P3、4P4,Se处于半充满,第二个电子更难失去,电离能最大;
x 价电子排布式为 ns n np n ,元素 z 基态原子 s 电子总数与 p 电子总数相等,w 与其它四种元素能层数不同,且未成对电子数目为 1 个。由相同原子构成的分子称为单质分子。【板书】一、电子转移的表示方法(1)双线桥法:(2)单线桥法:【讲述】单线桥表示反应过程中,电子由还原剂转移给氧化剂的情况,从失电子的原子出发,箭头指向得电子的原子,箭头上标出电子转移总数,不需标明“失去”或“得到”字样。
(4)离子之间存在离子键,非金属元素之间形成共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键,氧原子和氢原子间存在氢键;

(5)配合物K2[Cu(CN)4]是离子晶体;在CN-中碳原子与氮原子是以共价三键结合的,含有1个?键,2个π键;
(6)利用均摊法计算两种金属原子个数之比,根据ρ=$\frac{m}{V}$计算.
3.构造原理构造原理:多电子原子的核外电子排布遵循构造原理,根据构造原理可以写出元素基态原子的电子排布式。2.能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。 吸收 发射 原子 光谱分析 举例说明光谱分析的应用: 科学家们通过太阳光谱的分析发现了稀有气体氦,化学研究中利用光谱分析检测一些物质的存在与含量等 高中化学:第一章第一节《原子结构》课件:ppt(人教版选修3) 第一章 物质结构与性质 第一节 原子结构 1、进一步认识原子核外电子的分层排布 2、知道原子核外电子的能层分布及其能量关系 3、知道原子核外电子的能级分布及其能量关系 4、能用符号表示原子核外的不同能级,初步知道量子数的涵义 5、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 6、能用电子排布式表示、简化电子排步式常见元素(1~36号)原子核外电子的排布 学习目标 背景知识回顾 1、。
故答案为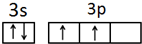 ;
;

(2)As、Se、Br同属第四周期元素,电离能从左到右逐渐增大,失去第1个电子后,价电子层的P能级上分别是4P2、4P3、4P4,Se处于半充满,第二个电子更难失去,电离能最大,三种元素的第二电离能从小到大的顺序为I2As<I2Br<I2Seseo3等电子体,
故答案为:I2As<I2Br<I2Se;
(2)气态SeO3分子中中心原子的价层电子对数为$\frac{6+0}{2}$=3,无孤电子对,所以分子构型为平面三角形,又等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-,
故答案为:平面三角形;CO32-或NO3-;

(4)铜离子和硫酸根离子之间存在离子键,硫原子和氧原子间存在极性共价键,铜原子和氧原子间存在配位键,氧原子和氢原子间存在氢键,
故答案为:ABDE;
解析:根据质量守恒定律的含义(即六不变)中的“元素的种类不变、原子的种类不变、原子的数目不变”可知,x中应该含有氮元素和氢元素,其化学式中应该含有氮原子和氢原子,并且其原子个数分别是1和3。(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(3)根据化合物中元素的质量分数及一定质量的物质中元素的质量计算方法来解答.解答:解:(1)由“瘦肉精”的化学式为c12h18cl2n2o,则1个分子中含有12个碳原子、18个氢原子、2个氯原子、2个氮原子、1个氧原子,即碳、氢、氯、氮、氧的原子个数比为12:18:2:2:1,故答案为:12:18:2:2:1。3.在40 gpa高压下用激光器加热到1 800 k时成功地制得了原子晶体co2,下列有关推断正确的是 ()a.原子晶体co2易汽化,可用作制冷剂b.构成原子晶体co2中的微粒是co2分子c.原子晶体co2有很高的熔沸点,有很大的硬度d.每摩尔原子晶体co2中含碳氧键的数目为2na答案c解析该“co2”晶体为原子晶体,不再有单个的co2分子,具有很高的熔、沸点和硬度,每摩尔晶体中应含有4na个碳氧键。
故答案为:离子晶体;2NA;

(6)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Cu原子与Au原子个数之比=3:1,
ga和as的摩尔质量分别为mga g·mol-1和mas g·mol-1,原子半径分别为rga pm和ras pm,阿伏加德罗常数值为na,则gaas晶胞中原子的体积占晶胞体积的百分率为。a.b晶胞的棱长分别为acm和bcm,体积分别为a3cm3.b3cm3,晶胞的密度等于晶胞中铁原子的质量与体积的比,为2m/a3:4m/b3=b3:2a3,。(2)根据均摊法确定晶胞中各种原子的个数,确定氧化物的化学式,结合密度计算晶胞的体积,进而求得晶胞的边长,两个离得最近的钙离子是位于顶点和面心上的,它们的距离为晶胞边长的 .。
故答案为:3:1;$\frac{\frac{197+64×3}{{N}_{A}}}{(a×1{0}^{-7})^{3}}$.
点评 本题主要考查了价电子排布图、第二电离能、分子空间构型、等电子体、晶胞密度的计算等,解题时要注意对基本知识的灵活运用,第二电离能的判断较难,第(6)题中单位是nm,容易出错seo3等电子体,本题综合性强,难度较大.
获取整本练习册答案,下载作业精灵立即下载
是狗天性多自负