鲁科版高中化学必修一第3章《自然界中的元素》单元测试题(解析版)

第3章《自然界中的元素》单元测试题一、单选题(每小题只有一个正确答案)1.有3份等量的烧碱溶液,第1份直接与盐酸反应;第2份稀释一倍,再与盐酸反应;第3份通入适量的CO2后,再与盐酸反应.若盐酸的浓度相同,完全反应时消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是( )A.V1=V2=V3 B.V1>V3>V2 C.V2>V3>V1 D.V1>V2>V32.将Mg、Cu组成的2.64 g混合物投入适量稀硝酸中,固体完全溶解时收集到的还原产物NO气体0.896 L(标准状况),向反应后溶液中加入2 mol/L NaOH溶液60 mL时金属离子恰好沉淀完全。则形成沉淀质量及硝酸物质的量分别为()A. 4.32 g0.02 mol B. 4.68 g0.16 molC. 5.36 g0.18 mol D. 6.38 g0.2 mol3.下列反应中硝酸既表现氧化性又表现酸性的是()A. H2SO3 与稀HNO3 反应B. 铁和热的浓HNO3C. Ag 和稀硝酸共热D. Fe(OH)3 和稀HNO34.闪电时空气中有臭氧生成。下列说法正确的是( )A.O3和O2互为同位素B.O2比O3稳定C.等体积O3和O2含有相同质子数D.O3与O2的相互转化是物理变化5.铜跟1mol/L 的硝酸反应,若C(NO3—)下降0.2mol/L ,则C(H+)下降 ( )A.0.2mol/LB.0.4mol/LC.0.6mol/LD.0.8mol/L6.某化学兴趣小组利用MnO2 和浓HCl 及如图装置制备Cl2。
(8)co32- 能与bacl2溶液反应,生成白色的baco3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的co2气体.。(9)hco3-取含hco3-盐溶液煮沸,放出无色无味co2气体,气体能使澄清石灰水变浑浊或向hco3-盐酸溶液里加入稀mgso4溶液,无现象,加热煮沸,有白色沉淀mgco3生成,同时放出co2气体。(9)hco3- 取含hco3-盐溶液煮沸,放出无色无味co2气体,气体能使澄清石灰水变浑浊或向hco3-盐酸溶液里加入稀mgso4溶液,无现象,加热煮沸,有白色沉淀 mgco3生成,同时放出 co2气体.。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:。(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为。(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:① 质子的流动方向为(“从A到B”或“从B到A”)。② 负极的电极反应式为。(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是。若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是。17.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色 沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。(1)A、B、C、D的分子式分别为:A__________B_________C___________D_________。(2)写出下列各反应的化学方程式:A与B_______________________________________________B与水_______________________________________________B与NaOH溶液_______________________________________C与澄清石灰水_______________________________________18.中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。
请回答:(1)若Y为黄绿色气体,该反应的离子方程式为,B体现出的化学性质有。(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为。(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾的气体,该反应中氧化剂与还原剂的物质的量之比为。(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。写出A与X的溶液反应的离子方程式。19.高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题(1)实验室制取纯净氯气的实验中,除了二氧化锰、浓盐酸和浓硫酸,还需要___________、________(填写试剂或溶液名称)(2)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式:____________________(3)图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是(填“a”“b”或“c”)。(4)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为,该氢化物与足量盐酸反应的化学反应方程式为。
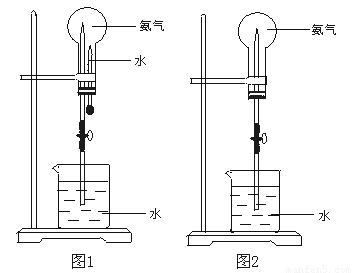
20.按要求书写相关反应的化学方程式:(1)硫在氧气中燃烧______________________。(2)在汽车的排气管上装一个催化转化装置,可以治理汽车尾气中的NO和CO,其原理是________(3)氨的催化氧化________________________。(4)制取漂白粉__________________________。(5)工业合成氨__________________________。三、实验题21.实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。编号ABC发生装置(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是(写编号);(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是(写编号),写出微热时的反应方程式;(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气。(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4 + 16HCl2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O①用“单线桥”在上述方程式上标出电子转移的方向和数目。②反应中元素被氧化,是氧化剂。当有1mol电子转移时,可生成气体 升(标准状态下)。
(4)下列气体中,能用固体氢氧化钠干燥的是()a.co2b.hclc.no2d.nh3e.no(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为_________________(用化学方程式表示)(6)上述干燥剂中,仅有浓硫酸为液体干燥剂,下列关于浓硫酸的叙述正确的是()a.浓硫酸具有吸水性,因而能使蔗糖炭化b.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体c.浓硫酸为液体干燥剂,干燥效率高,能用于干燥所有的气体d.浓硫酸在常温下能够使铁、铝等金属钝化(1)c(2分)(2)b、d、c、a(每空1分,共4分)(3)化学变化(2分)(4)de。(1)木炭粉与浓硫酸发生反应产生so2和co2气体,反应的方程式为2h2so4(浓)+c△.2so2↑+co2↑+2h2o,故答案为:2h2so4(浓)+c△.2so2↑+co2↑+2h2o。固体2和稀盐酸反应生成溶液3,且需要无氧条件,溶液3中加入碱在无氧条件下生成白色沉淀2,白色沉淀2被空气氧化生成红褐色沉淀,则白色沉淀2是fe(oh)2,溶液3为fecl2,x仅含4种元素,碳酸盐分解生成二氧化碳气体和两种氧化物,其中一种氧化物能溶于水,结合地壳的成分猜测固体1中成分为cao、feo,对应地,x应为cafe(co3)2,结合题中信息:10.80g x在惰性气流中加热至完全分解,得到6.40g固体1,经计算,确认x为cafe(co3)2,那么,溶液1是ca(oh)2,白色沉淀1是caco3,溶液2是ca(hco3)2,。
各物质间的转化关系如下图所示:请回答:(1)D中化学键的类型为________,C的电子式,B的空间构型为_________。(2)写出A的溶液与足量NaOH溶液反应的离子方程式。(3)写出J与K反应的化学方程式。(4)在标准状况下4.48L的H与I恰好被100mlNaOH溶液完全吸收,所需NaOH溶液的物质的量浓度为mol·L-1。(5)工业尾气中含有各种氮的氧化物(主要是NO和NO2,表示为NOx),NOx是严重的大气污染物,处理这些废气方法之一是通入适量的B,反应后会生成一种无色无味的气体。写出NOx与B反应的化学方程式______________________________。24.(14分)下图中的每个方格表示有关的一种反应物或生成物。其中A、C为无色气体。完成下列问题:(1)物质M可以是或,C是,F是。(2)淡黄色粉末的电子式是:。(3)反应①的化学方程式:。(4)反应②的离子方程式:。五、计算题25.某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):请确定混合物的组成和各自的质量26.已知: MnO2 +4HCl(浓)MnCl2 + Cl2↑+ 2H2O。
一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:(1)反应耗用MnO2的质量是______________ ;(2)被氧化的HCl物质的量是______________ ;(3)原浓盐酸的物质的量浓度是______________.参考答案1.A【解析】试题分析:最后生成物质的都为NaCl,根据Na原子、Cl原子守恒:n(HCl) = n(NaCl)= n(NaOH) ,由于NaOH物质的量相等,则消耗HCl的物质的量相等,故消耗盐酸的体积相等,即V1=V2=V3,答案选A。【考点定位】本题考查化学方程式有关计算【名师点晴】该题侧重于学生的分析能力和计算能力的考查,题目难度不大,注意根据元素质量守恒进行计算,可省去中间过程的繁琐。2.B【解析】硝酸被还原为NO气体且标准状况下体积为0.896L,即物质的量为0.896L22.4L/mol=0.04mol,所以转移的电子的物质的量为0.04mol×(5-2)=0.12mol。最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于2.64g+0.12mol×17g/mol=4.68g。
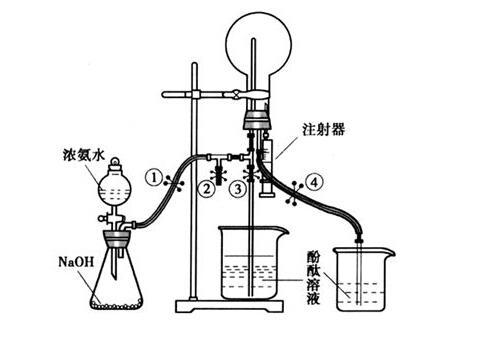
(6)由苯乙烯制取,比较二者结构可知,碳答案(1)碳碳双键、羟基(2)③④⑤(5)不能,因a中含有碳碳双键,用o2氧化羟基时,可能同时会将碳碳双键氧化5.(2017·天津理综,8)2-氨基-3-氯苯甲酸(f)是重要的医药中间体,其制备流程图如下:已知:回答下列问题:(1)分子种,共面原子数目最多为。3.6.3不接氧化管的吸收管测得的是二氧化氮浓度,接氧化管的吸收管测得的是一氧化氮和二氧化氮的总浓度,由后者浓度减去前者浓度,即为一氧化氮浓度(或前吸收管测得的是二氧化氮浓度,后吸收管测得的是一氧化氮浓度)。1.89 条件:计算值非生物降解 -空气,间接光氧化:时间1/2=7.9小时 条件:感光剂:oh基团 降解产物:二氧化碳/盐酸/氯化氢 -空气,光分解,odp=0.11 结论:在同温臭氧区域效果有限 cfc 11的参考值:odp=1 -空气,温室效应gwp=0.12 cfc 11的参考值 -水/土壤 结论:少量的水解和光解生物降解 -氧化测试:易于在封闭瓶内生物降解,在28天内降解性介于3-10%, 结论:不易于生物降解 -氧化测试:甲烷氧化的生物降解性,降解值在20小时是100% 结论:迅速大量的生物降解潜在的生物积累 -生物浓度:log po/w=2.3 结论:潜在的生物积累性很弱。
宋茜森林的精灵