第六章电解质溶液第六章电解质溶液电化学研究对象:电化学是研究

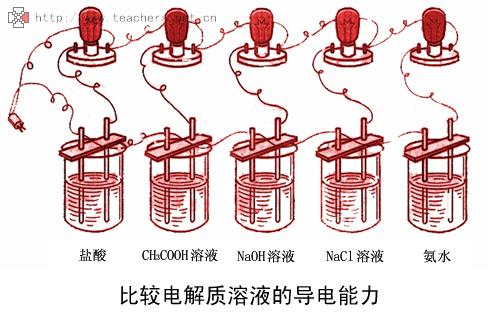
第六章电解质溶液第六章电解质溶液电化学研究对象:电化学是研究电能与化学能之间相互转化以及转化过程中所遵循的规律,在这些研究中常涉及电解质溶液。之间相互转化以及转化过程中所遵循的规律,在这些研究中常涉及电解质溶液。电解质溶液是一种可以导电的液态物质,即为一种导体。它与固态金属导体的导电机制不同。是一种可以导电的液态物质,即为一种导体。电解质溶液分类它与固态金属导体的导电机制不同。电能化学能电解电池第六章电解质溶液6-1 导体的分类6-2 电解质溶液导电原理6-3 离子的水化作用6-4 电导、电导率6-5 离子的电迁移6-6 电解质溶液的活度电化学的用途⒈电解 精炼和冶炼有色金属和稀有金属;电解法制备化工原料;电镀法保护和美化金属;还有氧化着色等。⒉电池 汽车、宇宙飞船、照明、通讯、生化和医学等方面都要用不同类型的化学电源。⒊电分析⒋生物电化学结束§6-1 导体的分类A 自由电子作定向移动而导电又称电子导体,如金属、石墨等。1. 第一类导体一、按导电机制不同导体可以分为两类A.自由电子作定向移动而导电B.导电过程中导体本身不发生变化C.温度升高,电阻也升高D.导电总量全部由电子承担A.正、负离子作反向移动而导电B.导电过程中有化学反应发生C 温度升高电阻下降⒉ 第二类导体又称离子导体,如电解质溶液、熔融电解质等。
C.温度升高,电阻下降D.导电总量分别由正、负离子分担*固体电解质,如等,也属于离子导体,但它导电的机理比较复杂,导电能力不高,本章以讨论电解质水溶液为主。2AgBrPbI、二、电解质的分类(根据电离程度不同):强电解质:在溶液中或熔融状态下完全电离成正、负离子。弱电解质:只有部分电离。强、弱电解质的划分不仅与电解质的本性有关,还与溶剂性质、溶液组成有关。不仅与电解质的本性有关,还与溶剂性质、溶液组成有关。如KI溶于水中形成的溶液为强电解质;而在丙酮或醋酸中为弱电解质。中为弱电解质。三、按价型不同分类NaCl1-1型电解质Na2SO4 1-2型电解质CuSO42-2型电解质1,1ZZ 1,2ZZ 2,2ZZ 结束§6-2 电解质溶液导电原理一、电解池与原电池1 正、负极与阴、阳极2 电解池与原电池1 正、负极与阴、阳极2 电解池与原电池电解池利用电能以发生化学反应的装置电解池:利用电能以发生化学反应的装置。电解质→水→电离:正离子→负极(外电场)负离子→正极(外电场)负离子在正极,失电子,发生氧化反应——阳极正离子在负极,得电子,发生还原反应——阴极阴:阳:。
电解质→水→电离:正离子→负极(外电场)负离子→正极(外电场)负离子在正极,失电子,发生氧化反应——阳极正离子在负极,得电子,发生还原反应——阴极阴:阳:222HeH222ClCle原电池:利用化学能转化为电能装置。正极、负极电势高的极称为正极,电流从正极流向负极。在原电池中正极是阴极;在电解池中正极是阳极。正极:电势低的极称为负极,电子从负极流向正极。在原电池中负极是阳极;在电解池中负极是阴极。负极:阴极、阳极发生还原作用的极称为阴极,在原电池中,阴极是正极;在电解池中,阴极是负极。阴极:(Cathode)发生氧化作用的极称为阳极,在原电池中,阳极是负极;在电解池中,阳极是正极。阳极:(Anode)离子迁移方向离子迁移方向:阴离子迁向阳极Anion AnodeCation Cathode阳离子迁向阴极原电池(galvanic cell)Zn(S)→Zn2++2e-发生氧化作用,是阳极。电子由Zn极流向Cu极,Zn极电势低,是负极。Zn电极:Cu2++2e-→ Cu(S)发生还原作用,是阴极。

2.新型电池“放电”时,电极反应式的书写首先根据电池反应分析物质得失电子情况,然后再考虑电极反应生成的物质是否跟电解质溶液巾的离子发生反应。发生电解反应的条件:①连接直流电源②阴阳电极 阴极:与电源负极相连为阴极阳极:与电源正极相连为阳极③两极处于电解质溶液或熔融电解质中④两电极形成闭合回路电解过程中的能量转化:阴极:一定不参与反应 不一定是惰性电极阳极:不一定参与反应 也不一定是惰性电极电解结果:在两极上有新物质生成电解池电极反应方程式的书写:阳极:活泼金属—电极失电子。 2、电镀 电极反应式 阳极: 2cl - -2e- cl2↑ 阴极: 2h+ + 2e- h2 ↑ 总反应: 2nacl+2h2o 2naoh +h2 ↑ +cl2↑ 电镀铜原理 铜片 待镀件 硫酸铜溶液 阳极:镀层金属 电镀液:含有镀层金 属的电解质 阴极:待镀金属制品 电解铜原理演示 电极反应式 阴极(纯铜): cu2+ + 2e- cu 还原反应 阳极(粗铜): cu - 2e- cu2+ 氧化反应 zn - 2e- zn2+ ni-2e- ni2+ 阳极泥: 相对不活泼的金属以单质的形式沉积在电解槽底,形成阳极泥 3、电冶金 制取金属钠 电解熔融状态的氯化钠。
甲醛传感器为燃料电池型电化学传感器,甲醛和氧气在工作电极和对电极上发生相应的氧化还原反应并释放电荷形成电流,产生的电流大小与甲醛的浓度成正比并遵循法拉第定律,通过测试电流的大小即可判定甲醛浓度的高低。 首先,根据法拉第定律,金属离子在电极还原为金属的多少与通电量成正比,因此,电流是影响镀层厚度的重要因素,具体到电镀工艺中,就是电流密度的影响,电流密度高,镀层沉积的速度也高。】十一、电流定律 ⒈电量q:电荷的多少叫电量,单位:库仑。
对同一电极,l/a不变,可用k表示(k称为电导池常数),因此,被测溶液的电导率和电导的关系为:。5.将两个铂电极插入500mlcuso4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为( )。发生电解反应的条件:①连接直流电源②阴阳电极 阴极:与电源负极相连为阴极阳极:与电源正极相连为阳极③两极处于电解质溶液或熔融电解质中④两电极形成闭合回路电解过程中的能量转化:阴极:一定不参与反应 不一定是惰性电极阳极:不一定参与反应 也不一定是惰性电极电解结果:在两极上有新物质生成电解池电极反应方程式的书写:阳极:活泼金属—电极失电子。

通电前cuso4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。d.用惰性电极电解含有一定浓度的cuso4溶液,一段时间后需加入0.1molcu(oh)2才可以恢复至原来的浓度和体积,则在电解过程中转移了0.4mol电子。2、酸、碱、盐溶液电解规律(惰性电极) 3、关计算的方法规律有关电解的计算通常是求电解后某产物质量、气体的体积、某元素的化合价以及溶液的ph、物质的量浓度等。
强弱电解质的相同点C↓↑m强、弱电解质的相同点:C↓, ↑ m强、弱电解质的不同点:强电解质C↓,↑幅度小,且小,且C →0, 趋于一极限值,称为, 趋于一极限值,称为无限稀释摩尔电导率。科尔劳施发现的关系图。在。科尔劳施发现的关系图。在稀溶液范围成直线关系,可外推获得强电解质的。而的。而弱电解质弱电解质不存在此种关系,不能用外推法求。不存在此种关系,不能用外推法求。mmm/mC C 与mm3298 ,1K Cmol dm四、电导的测定 及和的计算四、电导的测定 及和的计算1、G 的测定:通过测R来得求G.用惠斯通电桥来测溶液的R。调 R通过测R来得求G.用惠斯通电桥来测溶液的R。调 R2使T表为零时:mAAGGll已知,只需测得 和即可得1 RRRRR1GRA2、的测定2、的测定:取决于电导池的几何特征,称为电导池常数(或电极常数)。电导池常数直接测定有困难,往往用间接法测。即:用此电解池测已知电导率溶液(常用KCl)的电导,来求电导池常数。测。即:用此电解池测已知电导率溶液(常用KCl)的电导,来求电导池常数。
1.70.3>1.70=0.90>0.93.1解:log34>log33=log44>log43例6 溶液酸碱度的测量.溶液酸碱度是通过ph刻画的. ph的计算公式为ph=-lg[h+],其中[h+]表示溶液中氢离子的浓度,单位是摩尔/升. (1)根据对数函数性质及上述ph的计算公式,说明溶液酸碱度与溶液中氢离子的浓度之间的变化关系。相同温度下,向两支盛有等体积、等浓度h2o2溶液的试管中分别滴入适量的cuso4溶液和fecl3溶液,由于阳、阴离子均不同,所以不是唯一变量,不能说明是cu2+、fe3+对h2o2分解速率的影响,d项错误。当量浓度=溶质的克当量数/溶液体积(升)mol/l叫摩尔浓度,即溶液的浓度用1升溶液中所含溶质的摩尔数来表示.例如1升浓硫酸中含18.4摩尔的硫酸,则浓度为18.4mol。
在离子浓度无限稀时的离子的摩尔电导率称作离子的无限稀释摩尔电导率离子的无限稀释摩尔电导率。用表示。在离子浓度无限稀时,离子间的相互作用可以忽略,此时离子的运动可以认为是彼此独立的,称为。用表示。在离子浓度无限稀时,离子间的相互作用可以忽略,此时离子的运动可以认为是彼此独立的,称为离子独立运动。此时离子的电迁移率和电导率不受其它离子的影响,只与离子的种类和溶剂性质有关。此时离子的电迁移率和电导率不受其它离子的影响,只与离子的种类和溶剂性质有关。mSV三、电解质电导与离子电导的关系无限稀释时,正、负离子运动彼此独立,因而电解质的为两离子无限稀释摩尔电导率之和:此式称作离子独立运动定律。其中分别为正、负离子的化学计量数。无限稀释时,正、负离子运动彼此独立,因而电解质的为两离子无限稀释摩尔电导率之和:此式称作离子独立运动定律。其中分别为正、负离子的化学计量数。四、电解质的电导率与离子电迁移率的关系正、负离子的电迁移速率为m、( / )VV m s、正、负离子的电迁移速率为正、负离子的浓度分别为电解质截面积为则通过参考截面的电流正、负离子的浓度分别为电解质截面积为则通过参考截面的电流I是1秒钟内正、负两种离子导通电流之和。
每秒通过A的正、负离子的量秒钟内正、负两种离子导通电流之和。每秒通过A的正、负离子的量( / )VV m s、3(/)CC mol m、2()A mIIIV C A V C A、Iz FV C A则Iz FV C A此式为1-1型、2-2型等等价离子电解质的电导率与离子电迁移率间的关系其摩尔电导率与电迁移率关系为Iz FV C A则Iz FV C AIz FV C Az FV C A,zzz CCC若()IzCFA VV则EEVUVUll,()IzCFA UUEAIERl又知()zCF UU电迁移率间的关系。其摩尔电导率与电迁移率关系为:五、离子的迁移数电解质溶液导通电量由正、负离子共同完成。每种离子导通的电量只占总电量的一部分,称离子迁移数,分别用表示电解质溶液导通电量由正、负离子共同完成。每种离子导通的电量只占总电量的一部分,称离子迁移数,分别用表示:m()mzF UUC tt和QIQIttQIQI,根据离子独立运动定律可得1ttEEIzCFAUIzCFAUll,()EIzCFAUUlUUttUUUUVVttVVVVEVUlEVUlIz FV C A则Iz FV C A根据离子独立运动定律可得:mt t ,mmtt tt、 可由实验测定,由上式可求得 、结束m§6-6 电解质溶液的活度由于正、负离子间存在相互作用(静电引力),再加上离子的水化等复杂因素,即使离子浓度很稀,也使电解质溶液的行为与理想稀溶液有偏差。
但绝对不能剥夺公民议论社会