【整合】人教版高中化学必修一:4.4氨硝酸硫酸(教案3)(第1课时氨)

第四节 氨 硝酸 硫酸:《硫酸》说课稿二479。第四节 氨 硝酸 硫酸:硝酸说课稿二467。第四节 氨 硝酸 硫酸:《硝酸》说课稿三468。

如由碳元素组成的金刚石、石墨物理性质的差异之大,硫酸由于浓、稀的不同而引起性质上有本质的不同。2.氨气易溶于水(喷泉实验)。()实验室用氧化钙固体与浓氨水反应来制备氨气.已知氨气极易溶于。
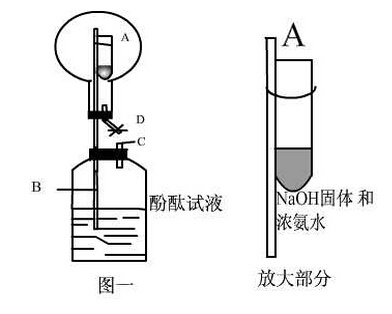
教师强调,氨气是在水中溶解度最大的气体。【过渡】利用氨气极易溶于水的性质,我们可以这一个“喷泉实验”。【实验演示】氨气的喷泉实验。在干燥的圆底烧瓶里充满氨气,使玻璃管插入有水的烧杯里(水里事先加入少量酚酞试液),胶头滴管里有水。开始触发喷泉,打开橡皮管上的夹子,挤压滴管的胶头,使少量水进入烧瓶。【观察现象】挤压胶头滴管后形成红色的喷泉。【提问】氨为什么会形成喷泉?【学生回答】氨气极易溶于水,使烧瓶内压强减小,瓶内外形成较大的压强差;大气压将水压入烧瓶。【提问】水溶液呈红色,说明氨气仅仅是溶于水吗?还有什么其他的性质?【学生回答】氨水具有碱性。【教师讲解】氨气与水反应生成一元弱碱NH3.H2O,部分电离成NH4+和OH-,,使得氨水呈碱性。NH3+H2ONH3.H2ONH4++OH-。【提问】形成喷泉的原理?只有氨气能做喷泉实验吗?【学生回答】不止氨气,只要能形成巨大压强差就可以实现“喷泉”。【教师讲解】可以形成喷泉的气体可溶液的组合有HCI-水;SO2-NaOH;CO2-NaOH等。【提问】若实验室只有单孔塞,能否用上述装置进行喷泉实验?如能,应如何触发喷泉?【学生回答】热毛巾敷在圆底烧瓶上。

【提问】若 VL烧瓶充满标况下的氨气,喷泉实验后溶液充满整个烧瓶,所得溶液物质的量浓度?【学生回答】1/22.4 mol/L。【提问】如果将氨气换成NO2,溶液浓度是多少?换成NO2:O2为4:1的混合气体,溶液浓度都是多少?【学生回答】换成氨气浓度还是1/22.4 mol/L;换成NO2:O2为4:1的混合气体,溶液浓度为4/5. 1/22.4 mol/L。【过渡】我饿们学习了氨气的物理性质,下面我们学习氨气的化学性质。【教师讲解】角度1.从酸碱性的角度考虑----唯一的碱性气体NH3+H2ONH3.H2ONH4++OH-。【学生活动】NH3的检验方法之一:能使湿润的红色石蕊试纸变蓝。【教师讲解】分析氨水的成分,比较氨水与液氨的区别。名称氨水液氨成因氨气溶于水温或加压是纯净氨气液化物质类别混合物纯净物微粒种类NH3、H2O、NH3.H2O、NH4+、OH-、H+(极少)NH3【学生活动】写出氨气与酸和酸氧化物反应的方程式NH3+HCl=NH4Cl (现象:白烟);NH3+HNO3=NH4NO3 (现象:白烟);NH3+HNO3=NH4NO3 (无现象);NH3+H2SO4=NH4HSO4(无现象)。

26.【答案】 (1) 浓氨水 球形干燥管 (2) 装置f中会产生倒吸 (3) a b(4) 装置f中几乎不再产生气泡(5) 取最后的一次洗涤液于试管中,滴加agno3溶液,若无白色沉淀,则证明产品氮化镓固体已洗涤干净(6) gan+oh-+h2ogao2-+nh3↑【解析】(1)根据题中信息可知,装置a制取氢气,装置c制取氨气,不需要加热条件液体与固体作用制氨气,则仪器x中的试剂是浓氨水,仪器y的名称是球形干燥管。(4)通常状况下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,形成的溶液是氨水.实验室常用加热氯化铵和消石灰的固体混合物制取氨气,请完成下列问题:实验室制取氨气的发生装置应选择的发生装置是。()实验室用氧化钙固体与浓氨水反应来制备氨气,反应的发生装置应选择适用于固体与液体在常温下反应制取气体的装置a。
1.一种由工业芴制备9-芴酮的方法,其特征在于所述制备方法以碱为催化剂,以甲苯和水为溶剂,以季铵盐为相转移剂,以乙醇为重结晶溶剂,具体包括如下步骤: ①制备油相:将荷与季铵盐以50~300:1的摩尔比混合,溶于甲苯中,制备10~40wt%的溶液为油相。溶解性口诀五钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵溶解性口诀六钾钠铵硝溶强溶弱不溶溶解性口诀七:碱溶钾钠钡钙钾钠铵硝全溶碳酸盐溶钾钠铵盐酸盐除银不溶硫酸盐除钡银不溶特例:1.高氯酸的钾。感悟:从近3年全国i卷试题可以看出,生活中的化学、化学中的stse等基本上都是元素化合物知识的考查,广泛涉及具体物质的性质,3道选择题就涉及30多种物质的性质特点,考查到强氧化性酸与金属的反应、盐类水解与酯类水解、酸碱盐间的复分解反应、不稳定酸的分解反应、不活泼金属与盐溶液的氧化还原反应、侯氏制碱法的特殊反应、气体物质生成铵盐的化合反应、黑火药制备反应等10余种反应原理。
你要哪个