高中化学喷泉实验 【化学】高中化学必修一知识点总结

原标题:【化学】高中化学必修一知识点总结
高中化学必修一
第一章 从实验学化学
第一节 化学实验基本方法
一、熟悉化学实验基本操作
危险化学品标志,如酒精、汽油——易燃液体;
浓H2SO4、NaOH(酸碱)——腐蚀品
二、混合物的分离和提纯:
1、分离的方法:
①过滤:固体(不溶)和液体的分离。
②蒸发:固体(可溶)和液体分离。
③蒸馏:沸点不同的液体混合物的分离。
④分液:互不相溶的液体混合物。
⑤萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
2、粗盐的提纯:
(1)粗盐的成分:主要是NaCl,还含有MgCl2、CaCl2、Na2SO4、泥沙等杂质
(2)步骤:
①将粗盐溶解后过滤;
②在过滤后得到粗盐溶液中加过量试剂BaCl2(除SO42-)、Na2CO3(除Ca2+、过量的Ba2+)、NaOH(除Mg2+)溶液后过滤;
③得到滤液加盐酸(除过量的CO32-、OH-)调pH=7得到NaCl溶液;
④蒸发、结晶得到精盐。
加试剂顺序关键:
(1)Na2CO3在BaCl2之后;
(2)盐酸放最后。
3、蒸馏装置注意事项:
①加热烧瓶要垫上石棉网;
②温度计的水银球应位于蒸馏烧瓶的支管口处;
③加碎瓷片的目的是防止暴沸;
④冷凝水由下口进,上口出。
4、从碘水中提取碘的实验时,选用萃取剂应符合原则:
①被萃取的物质在萃取剂溶解度比在原溶剂中的大得多;
②萃取剂与原溶液溶剂互不相溶;
③萃取剂不能与被萃取的物质反应。
三、离子的检验:
①SO42-:先加稀盐酸,再加BaCl2溶液有白色沉淀,原溶液中一定含有SO42-。Ba2++SO42-=BaSO4↓
②Cl-(用AgNO3溶液、稀硝酸检验)加AgNO3溶液有白色沉淀生成,再加稀硝酸沉淀不溶解,原溶液中一定含有Cl-;或先加稀硝酸酸化,再加AgNO3溶液,如有白色沉淀生成,则原溶液中一定含有Cl-。Ag++Cl-=AgCl↓。
③CO32-:(用BaCl2溶液、稀盐酸检验)先加BaCl2溶液生成白色沉淀,再加稀盐酸,沉淀溶解,并生成无色无味、能使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32-。
第二节 化学计量在实验中的应用
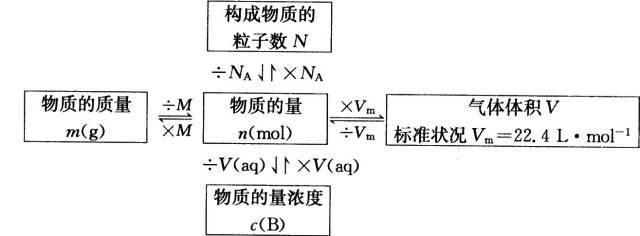
1、物质的量(n)是国际单位制中7个基本物理量之一。
2、五个新的化学符号:
①摩尔(mol)是物质的量的单位,只能用来衡量微观粒子:原子、分子、离子、原子团、电子、质子、中子等。
②用物质的量表示微粒时,要指明粒子的种类。
NA有单位:mol-1或 /mol,读作每摩尔,
NA≈6.02×1023mol-1。
①影响气体摩尔体积因素有温度和压强。
②在标准状况下(0℃,101KPa)1mol任何气体所占体积约为22.4L即在标准状况下,Vm≈22.4L/mol
3、各个量之间的关系:
4、溶液稀释公式:(根据溶液稀释前后,溶液中溶质的物质的量不变)
C浓溶液V浓溶液=C稀溶液V稀溶液 (注意单位统一性,一定要将mL化为L来计算)。
5、溶液中溶质浓度可以用两种方法表示:
①质量分数W
②物质的量浓度C
质量分数W与物质的量浓度C的关系:C=1000ρW/M(其中ρ单位为g/cm3)
已知某溶液溶质质量分数为W,溶液密度为ρ(g/cm3),溶液体积为V,溶质摩尔质量为M,求溶质的物质的量浓度C。
【 推断:根据C=n(溶质)/V(溶液) ,而n(溶质)=m(溶质)/M(溶质)= ρ V(溶液) W/M,考虑密度ρ的单位g/cm3化为g/L,所以有C=1000ρW/M 】。(公式记不清,可设体积1L计算)。
美爆了