偏铝酸的化学键类型

h3bo3晶体是分子晶体,相互之间通过氢键相连,每个b原子形成三个b-o极性键,每个o原子形成o-h共价键,共6个键。(2)ge与c是同族元素,c原子之间可以形成双键、叁键,但ge原子之间难以形成双键或叁键。《环境化学》 第三章 水环境化学二、水中颗粒物的聚集 1、物理凝聚理论颗粒随水流迁移,还是凝聚决定着 污染物的扩散迁移和沉降归宿凝聚 coagulation 电介质促成的聚集 絮凝 flocculation 聚合物促成的聚集 (1)前提:①颗粒粒度均等、球体 ②范德化引力和静电排斥力是仅有的作用因素 ③没有化学专属吸附作用 颗粒在水溶液中进行热运动,其平均动能为3/2 kt (2)理论描述 总的综合作用位能:vt = vr + va va——由范德华力产生的位能 vr——由静电排斥力所产生的位能2008-5-12 63。
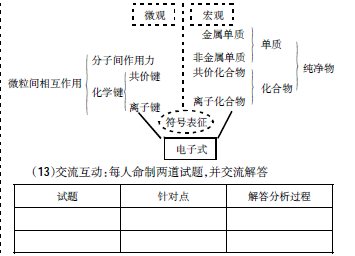
阴、 阳离子通过静电作用形成的化合物就是离子化合物。哪些物质能形成离子键?活泼的金属元素( IA, IIA) 和活泼的非金属元素( VIA, VIIA) 之间的化合物。活泼的金属元素和酸根离子、 氢氧根离子形成的盐或碱.铵根离子和酸根离子( 或活泼非金属元素离子) 形成的盐。离子化合物的判别离子化合物的判别:[思考](1) 活泼金属和活泼非金属形成的化合物(2) 强碱、 大多 数盐。(3) “类盐” : NaH、 Mg3N2、 CaC2……化合物中只要有阴阳离子就可判断为离子化合物。偏铝酸的化学键类型2、 电子式 在元素符号周围用 “ · ”或“× ”来表示原子最外层电子的式子, 叫电子式。H ·Na ··Mg ··Ca · ·O·····Cl ·······原子的电子式:离子的电子式:H+Na+Mg2+Ca2+[ O ]2-····::[ Cl ]-····::电子式的书写:1. 在元素符号周围用 小点(或× ) 来表示原子最外层电子的式子就是该原子的电子式。

2. 简单阳离子的电子式就是其离子符号。 Mg2简单阳离子的电子式就是其离子符号3. 阴离子要加方括号, 并注明所带电荷数。 Brg4. 离子化合物的电子式中, 相同离子不能合并, 一般分布在两侧。Mg2BrBr(1) 原子的电子式: 常把其最外层电子数用小黑点“. ”或小叉“ ×”来表示。(2) 阳离子的电子式: 不要求画出离子最外层电子, 只要在元素符号右上角标出“n+”电荷字样电荷字样。(3) 阴离子的电子式: 不但要画出最外层电子,而且还应用括号“[ ] ”括起来, 并在右上角标出“n·-”电荷字样。[ 练习 1] 写出 下列微粒的电子式:硫原子,溴原子,硫离子,溴离子·S·······[ 练习 2] 写出 下列微粒的电子式:Br ·········[ S ]2-······::[ Br ]-··:··:氟原子,铝原子,氟离子,铝离子离子化合物的电子式:AB型A2B型A2B型NaClNa2SNa2OAB2型MgCl2注: 阴、 阳离子的电子式相间写, 相同离子不能合并。
用电子式表示氧化钙、 氟化镁、 氧化钾过氧化钾3、 离子键的强弱根据离子键的成因, 离子键的强弱取决于成键离子的半径以及所带电荷数, 通常可以直接通过阴阳离子的半径大小来判断离子键的强弱。子键的强弱。如: 比较NaCl和MgCl2NaCl和NaBr课堂练习课堂练习练习 1、 下列说法正确的是:A. 离子键就是使阴、 阳离子结合成化合物的静电引 力B. 所有金属与所有非金属原子之间都能形成离子键C. 在化合物CaCl2中, 两个氯离子之间也存在离子键D. 钠原子与氯原子结合成氯化钠后体系能量降低D练习 2、 下列各数值表示有关元素的原子序数, 其所表示的各原子组中能以离子键相互结合成稳定化合物的是:A. 10与12B. 8与17 C. 11与17D. 6与14C3. 某Ⅱ A族元素 X 和ⅦA族元素 Y 可形成离子化合物, 请用 电子式表示该离子化合物。X2+[ Y ]-····::[ Y ]-····::写出下列粒子的电子式4.写出下列粒子的电子式:硫原子,溴离子,钾离子氯化钠氟化镁如何用电子式表示离子化合物的形成过程?例: 用 电子式表示氯化钠、 溴化钙的形成过程Cl ·······[ Cl ]-····Ca2+::Na · +····→ Na+Br · :+ ·Ca· → [ Br ]-·····Ca·+1.原子A的电子式 + 原子B的电子式→化合物的电子式····::2[ Br ]-····[ Br ]-····::Br · ····:Br · :+→Ca2+[ Br ]-····::::2.不能把“→” 写成“=”。
(3)金属键理论把金属键描述为金属原子脱落下来的价电子形成整块晶体的电子气,被所有原子所共用,从而把所有的原子联系在一起,可以用来解释金属键的本质,金属的延展性、导电性、传热性。(3)金属理论把金属键描述为金属原子脱落下来的价电子形成整块晶体的电子气,被所有原子所共用,从而把所有的原子联系在一起,可以用来解释金属键的本质,金属的延展性、导电性。4.氨气分子空间构型是三角锥形,而甲烷分子是正四面体,这是因为()a.两种分子的中心原子的杂化轨道类型不同,nh3为sp2型杂化,而ch4是sp3型杂化b.nh3分子中氮原子形成3个杂化轨道,ch4分子中碳原子形成4个杂化轨道c.nh3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强d.氨气分子是极性分子而甲烷是非极性分子解析:选cnh3和ch4的中心原子都是sp3杂化,故a、b错误。
其他含氮化合物的还原⒈ 偶氮化合物的还原——伯胺⒉ 叠氮化合物的还原氢解反应——在还原反应中碳-杂键断裂。p σ键d.ch4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个c—h σ键解析:选dbf3为平面三角形,nh为正四面体,ch4分子中碳原子的2s轨道与2p轨道形成4个sp3杂化轨道,然后与氢原子的1s轨道重叠,形成4个sp3。2.2 弱数据点和高分辨率截断2.3 残差因子2.4 参数2.5 约束2.5.1 位置占有率因子2.5.2 特殊位置约束2.5.3 刚性基团约束2.5.4 浮动原点约束2.5.5 氢原子2.5.6 shelxl中的约束用法2.6 限制2.6.1 几何限制2.6.2 位移参数的限制2.6.3 其他限制2.7 shelxl中的自由变量2.8 结果2.8.1 键长和键角2.8.2 扭转角2.8.3 共面原子2.8.4 氢键2.8.5 rtab指令2.8.6 more指令2.8.7 cif文件2.9 精修问题3 氢原子3.1 氢原子的x-h键长和ueq数值3.2 与不同类型原子成键的氢3.2.1 与碳原子成键的氢3.2.2 与氮或氧成键的氢3.2.3 与金属成键的氢3.3 在shelxl中定位氢原子3.3.1 hfix指令中最常用的m和n取值列表3.3.2 酸性氢原子的准自由精修3.4 xhelxl中的氢键信息3.5 示例3.5.1 常规氢原子定位操作:c31h54mon2023.5.2 zr基氢化物中的氢原子3.5.3 酸性氢原子和氢键4 原子类型的指定4.1 电子皆“蓝色4.2 化学知识4.3 晶体学知识4.4 示例4.4.1 四联.1 ncl3——n还是o。

4.氨气分子空间构型是三角锥形,而甲烷分子是正四面体,这是因为()a.两种分子的中心原子的杂化轨道类型不同,nh3为sp2型杂化,而ch4是sp3型杂化b.nh3分子中氮原子形成3个杂化轨道,ch4分子中碳原子形成4个杂化轨道c.nh3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强d.氨气分子是极性分子而甲烷是非极性分子解析:选cnh3和ch4的中心原子都是sp3杂化,故a、b错误。(3)物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体he、ne等单原子分子,cl2、n2、o2、h2双原子分子。6.在乙烯分子中有5个σ键、1个π键,它们分别是()a.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键b.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键c.c—h之间是sp2形成的σ键,c—c之间是未参加杂化的2p轨道形成的π键d.c—c之间是sp2形成的σ键,c—h之间是未参加杂化的2p轨道形成的π键解析:选a乙烯分子中,每个c原子都采用sp2杂化方式,每个c原子上各有3个sp2杂化轨道和未杂化的2p轨道,其中3个sp2杂化轨道中,1个用于与另一个c原子形成c—c σ键,2个用于与2个h原子形成c—h σ键,未参与杂化的2p轨道“肩并肩”重叠形成c—c π键。
(2) 物质分子的几种表示方法:碳原子的成键特征:观察图中几种含碳化合物的结构式, 分析:各化合物分子中每个碳原子能形成几个共价键?碳原子之间是怎样连接的?碳原子的成键特征:(1) 碳原子最外层有4个电子,可以形成四个共价键。(2) 碳原子间可以形成单键(C-C) 、双键(C=C) 、 叁键(C≡C) 。双键(C C) 、 叁键(C C) 。偏铝酸的化学键类型(3) 碳原子间可以结合成链状,也可以形成环状。结构式:乙烷: HH|||||H-C-C-H||||| H HH H H丙烷:H H HH-C-C-C-H 结构简式:CH CHCH3CH3CH3CH2CH3CH3CH2CH3结构式:结构简式:CH2=CH2共价键小结共价键小结1、 定义: 原子之间通过共用电子对所形成的相互作用2、 成键粒子: 原子3、 成键性质: 共用电子对对两原子的电性作用4、 存在: 同种或不同种非金属元素之间5、 表示方法: 电子式、 结构式共价键与离子键的比较:关于共价键的说法正确的是:A) 金属原子在化学反应中只能失去电子,因而不能形成共价键;B) 离子化合物中不可能含有共价键;C) 共价键也存在电子得失;C) 共价键也存在电子得失;D) 由共价键形成的分子可以是单质分子,也可以是化合物分子下列化合物分子中只有共价键的是:A)BaCl2C)(NH4)2SO4B)NaOHD)H2SO4用电子式表示MgF2 和H2S的形成过程.碘用 电子式表示下列共价分子I····I ··水氨氨:··::﹕﹕H o H﹕﹕硫化氢﹕﹕﹕H S H﹕﹕H N﹕H N H ﹕﹕H ﹕二氧化碳﹕ OCO﹕﹕﹕﹕﹕﹕﹕1 : ①NaOH的 OH-中O 、 H原子之间通过__键结合在一起, 所以NaOH中既有__键,又含有__.②CaCl2中含____键, 属于____化合物,两元素分别位于族和两元素分别位于____族和____族; SO2中含____键, 属于____化合物, 两元素的族序数为____, 所以AB2型化合物可能为____化合物,也可能为____化合物.族SO 中含练习分 子 间 作 用 力我们知道, 分子内相邻原子之间存在着强烈的相互作用。

那么, 分子之间是否也有相互作用呢?干冰升华、 硫晶体熔化、 液氯气化都要吸收能量。 物质从固态转变为液态或气态, 从液态转变为气态, 为什么要吸收能量?在降低温度、 增加压强时, Cl2、 CO2等气体能够从气态凝结成液态或固态。 这些现象给我们什么启示?讨论: 用化学键的观点来分析化学反应的本质是什么?一个化学反应的的过程, 本质上就是旧化学键断裂和新化学键形成的过程。干冰气化后化学性质是否发生变化?分子间作用力对物质化学性质有没有影响?有没有影响吸收能量干冰(构成微粒CO2分子)CO2气体构成微粒仍是CO2分子, CO2分子能自由移动晶体中CO2分子不能自由移动, 只能在平衡位置作振动克服分子间作用力分子间作用力1。 概念: 分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。2。 特点:A 比化学键弱得多A.比化学键弱得多 。B. 影响物质的熔沸点和溶解性等物理性质范德华力的特点1 .分子间普遍存在的一种作用力2.作用力弱3.主要影响物质的物理性质(熔沸点)由分子构成的影响 : 组成和结构相 似的 分子, 一般相 对分子质量越大 ,范德华力 越大 。 克服分子间 作用力 使物 质熔化和气化就需要更多的 能量, 熔、 沸 点越高。
个人认为国家发展