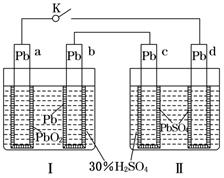
铅蓄电池的工作原理为Pb+PbO2+2H2SO通电.2PbS
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:

(2)原理图:


3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤x极增重或减重:x极质量增加,说明溶液中的阳离子在x极(正极)放电,反之,x极质量减少,说明x极金属溶解,x极为负极。5.x极增重或减轻工作后,x极质量增加,说明x极有物质析出,x 极为正极:反之,x极质量减少,说明x极金属溶解,x 极为负极。电解电容常见的故障有,容量减少,容量消失、击穿短路及漏电,其中容量变化是因电解电容在使用或放置过程中其内部的电解液逐渐干涸引起,而击穿与漏电一般为所加的电压过高或本身质量不佳引起.判断电源电容的好坏一般采用万用表的电阻档进行测量.具体方法为:将电容两管脚短路进行放电,用万用表的黑表笔接电解电容的正极.红表笔接负极(对指针式万用表,用数字式万用表测量时表笔互调),正常时表针应先向电阻小的方向摆动,然后逐渐返回直至无穷大处.表针的摆动幅度越大或返回的速度越慢,说明电容的容量越大,反之则说明电容的容量越小.如表针指在中间某处不再变化,说明此电容漏电,如电阻指示值很小或为零,则表明此电容已击穿短路.因万用表使用的电池电压一般很低,所以在测量低耐压的电容时比较准确,而当电容的耐压较高时,打时尽管测量正常,但加上高压时则有可能发生漏电或击穿现象.。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。 电极反应 电极材料 电解质溶液 装置图 负极 正极 思考与交流 氧化反应 还原反应 – + zn-2e- zn2+ cu2++2e- cu 硫酸铜溶液 zn cu e- so42- cu2+ a zn + cu2+ zn2+ + cu cu 原电池的工作原理 锌片失去电子,铜离子得到电子,两极之间溶液离子的定向移动和外部导线中电子的定向移动,构成闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。
电解池:

(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:s2->i->br->cl->oh->so42->no3->f- 阳离子放电顺序:ag+>hg2+>fe3+>cu2+>h+>pb2+>sn2+>fe2+>zn2+>al3+>mg2+>na+>ca2+>k+。强酸性阳树脂对水中各种阳离子的吸附顺序为:fe3+>al3+>ca2+>mg2+>na+>h+.。h2o=al(oh)3↓+3nh4+ 41、明矾溶液加热水解生成沉淀:al3++3h2o=al(oh)3↓+3h+ 42、氯化铝溶液与偏铝酸钠溶液:al3++3alo2–+6h2o=4al(oh)3↓ 43、偏铝酸钠溶液中加入氯化铁溶液:fe3++3alo2–+6h2o=fe(oh)3↓+3al(oh)3↓ 44、偏铝酸钠溶液中加入少量盐酸:alo2–+h++h2o=al(oh)3↓ 45、偏铝酸钠溶液中加入过量盐酸:alo2–+4h+=al3++2h2o 46、偏铝酸钠溶液中加入氯化铵溶液:alo2–+nh4++h2o=al(oh)3↓+nh3↑ 47、金属铁溶于盐酸中:fe+2h+=fe2++h2↑ 48、铁粉与氯化铁溶液反应:fe+2fe3+=3fe2+ 49、铜与氯化铁溶液反应:cu+2fe3+=cu2++3fe2+ 50、硫化亚铁与盐酸反应:fes+h+=fe2++h2s↑ 51、硫化钠与盐酸反应:s2–+2h+=h2s↑ 52、硫化钠溶液中加入溴水:s2–+br2=s↓+2br– 53、氯化亚铁溶液中通入氯气:2fe2++cl2=2fe3++2cl– 54、向硫酸铁的酸性溶液中通入足量的h2s:2fe3++h2s=2fe2++s↓+2h+ 55、氯化铁溶液中滴加少量硫化钠溶液:2fe3++s2–=s↓+2fe2+ 56、硫化钠溶液中滴加少量氯化铁溶液:2fe3++3s2–=s↓+2fes↓ 57、氯化铁溶液中滴加少量碘化钾溶液:2fe3++2i–=2fe2++i2 58、氯化铁溶液与氢氧化钠溶液反应:fe3++3oh–=fe(oh)3↓ 59、氯化铁溶液跟过量氨水反应: fe3++3nh3。
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;

③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。铅蓄电池的原理
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:m-ne-=mn+,镀件作阴极,阴极反应是:mn++ne-=m。金属阳极材料原型电铸层 离子化的金属离子向阴极区的电迁移图1 电铸原理示意电 沉 积电 镀 电 铸共同技术表面处理阳极材料挂具电解液的调整 原型的制作厚度电铸装置电铸金属的性质物理机械性能的调整 电沉积厚度电镀装置电镀层的性质光亮剂。例如:电解精炼铜,将粗铜作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,在阳极铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子析出,从而提纯了铜。
香港也是如此