高中化学第四章第4节氨硝酸硫酸第1课时课件新人教版必修

1、别?液氨氨水物质种类粒子种类纯净物混合物NH离子:NH+、OH_、微量H+分子:NH、HO、NHHO(主要)(B)与酸反应步骤:使两根分别蘸有浓氨水和浓盐酸的玻璃棒接近。(不要接触)两根玻璃棒靠近时产生大量白烟。高中化学喷泉实验现象:结论:()盐酸、氨水均具有挥发性,()NH、HCl不能共存。NH+HClNHCl检验氨气法二浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?分别与硫酸和硝酸反应的化学方程式。与浓硝酸:NH+HNO=NHNO(产生白烟)与浓硫酸:NH+HSO=(NH)SO(不产生白烟)挥发性酸(HCl、HNO等)遇氨气均有白烟生成;难挥发性酸(HSO、HPO)无此现象。NH+HNO=NHNONH+HSO=(NH)SONH+HCl=NHCl白烟NH能不能用浓硫酸干燥?不能氨气与酸反。

氨气,无机化合物,常温下为气体,无色有刺激性恶臭的气味,易溶于水,氨溶于水时,氨分子跟水分子通过氢键结合成一水合氨(nh3·h2o),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。 根据上述调整时加酸或加氨水的体积,往剩余 980ml 氨-硫酸铵缓冲溶液中,加入 所需硫酸溶液(1+3)或 10%氨水,以保证以后配制的氨性靛蓝二磺酸钠溶液的 ph 等 于 9.0。向agno3溶液滴加氨水或向氨水中滴加agno3溶液,都能得到银氨溶液,只不过现象不同。
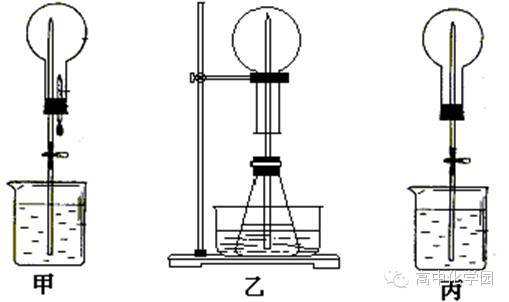
3、温高压催化剂高温高压催化剂()人工固氮工业合成氨将游离态的氮转变为化合态的氮的方法。()自然固氮:、生物固氮:豆科植物固氮、高能固氮:雷雨天产生一氧化氮气体N+ONO放电、氨()物理性质物理性质色态:无色气体密度:密度比空气小溶解性:极易溶于水(:)气味:有刺激性气味熔沸点:较低(易液化)如何收集?作制冷剂【实验_】喷泉实验()引发喷泉的操作是什么?()喷泉实验成功的关键?()圆底烧瓶中为什么会形成喷泉?观察实验并思考:实验现象:a烧杯内的水由玻璃管进入烧瓶内形成喷泉;b烧瓶内溶液呈红色。a氨极易溶于水。b氨水显碱性。实验结论:引发图产生喷泉实验的操作?引发图产生喷泉实验的操作?图引发喷泉操作包括:挤胶头滴管及打开止水夹图引发喷泉操作包括:热毛巾捂住烧瓶外壁一会儿及打。

天然气先经脱硫,然后通过二次转化,再分别经过一氧化碳变换、二氧化碳脱除等工序,得到的氮氢混合气,其中尚含有一氧化碳和二氧化碳约0.1%~0.3%(体积),经甲烷化作用除去后,制得氢氮摩尔比为3的纯净气,经压缩机压缩而进入氨合成回路,制得产品氨。集四海化工品分析检测中心检测实验室为cma国家认证,cnas国际认可实验室,下设物理实验室、化学实验室、微生物实验室、热性能实验室、适用性实验 室、老化实验室六大试验室,可根据iso、astm、gb、hb、yy等标准对900余种化工品进行物理性质、力学性质、适用性测试。实验类型:综合实验实验要求:必修实验内容:(1)三氯化六氨合钴(Ш)的合成,(2)三氯化六氨合钴(Ш)组成的测定,(3)三氯化六氨合钴(Ш)摩尔磁化率的测定。
5、的实验室制法、实验室用什么原料制取NH?反应原理是什么?、根据制氨气的反应原理,应选用什么样的装置?这套装置还可以制取什么气体?、如何收集NH?如何验满?、实验中制得的NH含有少量的HO,如何干燥氨气?、NH是一种污染性气体,为避免污染空气,实验中多余的氨气应如何进行吸收处理?、氨气的实验室制法()装置:固+固加热型(还可用于制取氧气)()药品:氯化铵晶体、消石灰固体()原理:NHCl+Ca(OH)CaCl+NH↑+HO△()收集:向下排空气法()干燥:碱石灰不可用:PO、浓硫酸、CaCl()检验或验满①湿润的红色石蕊试纸变蓝(唯一的一种碱性气体)②蘸有浓HCl的玻璃棒接近试管口产生白烟。()尾气吸收:常见防倒吸装置水装置:倒扣漏斗试管口棉花的作用:防止空气对流,提。高中化学喷泉实验
6、止水夹、喷泉实验如何实现呢?、形成喷泉的原理?烧瓶内外形成压强差、喷泉实验成功的关键?a装置的气密性好;b气体的纯度高;c烧瓶必须干燥。、通过氨气的喷泉实验得到启发,我们该如何设计一个CO的喷泉实验。、哪些气体和溶液间也能形成喷泉?水与HClNHNaOH溶液与ClSOCO氨水为什么会显碱性呢?()化学性质(A)与水反应NH+HO(D)(一水合氨)(弱碱)氨水中含少量氢氧根离子,呈弱碱性,故能使酚酞试液变红。NHHONH++OH_氨水显碱性的原理NHHONH↑+HONHHO不稳定:氨气:能使无色的酚酞溶液变成,又能使湿润的红色的石蕊试纸。变红变蓝检验氨气法一NH唯一的碱性气体高中阶段学习的)氨水中主要含有哪些微粒?三分子:NH、HO、NHHO三离子:NH+、OH_、H+。
7、高集气的速度和纯度。干燥氨气的常用试剂:注意:无水CaCl不能干燥NH(形成CaClNH)CaO、碱石灰等碱性干燥剂()其他常见的制取NH的方法①加热浓氨水法NHHONH↑+HO浓氨水CaO浓氨水原理:固体烧碱或生石灰溶于水时放出大量的热,促使NHHO分解放出氨气。②浓氨水滴加到CaO或固体NaOH上自然界中氮循环NHClNHHO实验室制氨气NNHNONOHNO①②③④⑤⑥⑦⑧⑨氮及其化合物之间的相互转换下列组合能形成明显喷泉并充满烧瓶的是()A干燥气体B液体ANO水BSOmolLNaOHCCl饱和食盐水DHCl水ABBD下列关于氨性质的叙述中正确的是()A、氨气可用排水法收集B、氨水呈碱性C、氨气和酸相遇都能产生白烟D、在反应NH+H+=NH+中,氨失去电子被氧化。

苦参粗粉,732型强酸性阳离子交换树脂,硅胶g,乙醇,浓氨水,氯仿,无水硫酸钠,丙酮,甲醇,2mol/l hcl,0.1%hcl,5%naoh溶液,氢氧化钠,乙醚, 5% 钼酸铵,浓硫酸,浓硝酸,漂白粉,碘化铋钾试剂,改良的碘化铋钾试液,碘化汞钾试剂,硅钨酸试剂,10% 硫酸铜试剂,氯化汞乙醇溶液,0.1%h2so4奎宁水溶液,0.1%h2so4小檗碱水溶液,0.1%h2so4阿托品水溶液,苦参生物碱水溶液(自制),1% 盐酸麻黄碱水溶液,盐酸小檗碱水溶液,氢溴酸东莨菪碱溶液,硫酸阿托品溶液等。5.2液体流程浓氨水由浓氨水泵从吸氨岗位浓氨水槽打入付塔,一方面溶解塔内的结疤,另一方面吸收主塔尾气中的剩余二氧化碳,逐步提高浓氨水的碳化度。氨气,无机化合物,常温下为气体,无色有刺激性恶臭的气味,易溶于水,氨溶于水时,氨分子跟水分子通过氢键结合成一水合氨(nh3·h2o),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。
9、反应(NH)CO=NH↑+CO↑+HO△NHHCO=NH↑+HO+CO↑△NHCl=NH↑+HCl↑△②铵盐与碱生成氨气NHNO+NaOH=NaNO+NH+HO△(NH)SO+NaOH=NaSO+NH↑+HO△反应实质NH+与OH_不大量共存应用:用于NH+的检验、实验室用来制NH产生的气体使湿润的红色石蕊试纸变蓝。应用:a用于NH+的检验:原理:利用与碱的反应检验NH+离子的存在操作:向样品中加入碱溶液,加热,若放出的气体能使湿润的红色石蕊试纸变蓝,证明含NH+。NaOH溶液待测液()固态反应,无离子方程式()浓溶液,不加热()稀溶液NH++OH_=NH↑+HONH++OH_=NH▪HO不加热加热NH++OH_NH↑+HO△有关铵盐和强碱反应的离子方程式的书写:、氨。
10、)化学性质(A)与水反应NH+HO(D)(一水合氨)(弱碱)氨水中含少量氢氧根离子,呈弱碱性,故能使酚酞试液变红。NHHONH++OH_氨水显碱性的原理NHHONH↑+HONHHO不稳定:氨气:能使无色的酚酞溶液变成,又能使湿润的红色的石蕊试纸。变红变蓝检验氨气法一NH唯一的碱性气体高中阶段学习的)氨水中主要含有哪些微粒?三分子:NH、HO、NHHO三离子:NH+、OH_、H+)氨水与液态氨有何区别?液氨氨水物质种类粒子种类纯净物混合物NH离子:NH+、OH_、微量H+分子:NH、HO、NHHO(主要)(B)与酸反应步骤:使两根分别蘸有浓氨水和浓盐酸的玻璃棒接近。(不要接触)两根玻璃棒靠近时产生大量白烟。现象:结论:()盐酸、氨水均具有挥发性,()NH、HCl不能共存。
11、的实验室制法、实验室用什么原料制取NH?反应原理是什么?、根据制氨气的反应原理,应选用什么样的装置?这套装置还可以制取什么气体?、如何收集NH?如何验满?、实验中制得的NH含有少量的HO,如何干燥氨气?、NH是一种污染性气体,为避免污染空气,实验中多余的氨气应如何进行吸收处理?、氨气的实验室制法()装置:固+固加热型(还可用于制取氧气)()药品:氯化铵晶体、消石灰固体()原理:NHCl+Ca(OH)CaCl+NH↑+HO△()收集:向下排空气法()干燥:碱石灰不可用:PO、浓硫酸、CaCl()检验或验满①湿润的红色石蕊试纸变蓝(唯一的一种碱性气体)②蘸有浓HCl的玻璃棒接近试管口产生白烟。()尾气吸收:常见防倒吸装置水装置:倒扣漏斗试管口棉花的作用:防止空气对流,提 。
12、。NH+HClNHCl检验氨气法二浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?分别与硫酸和硝酸反应的化学方程式。与浓硝酸:NH+HNO=NHNO(产生白烟)与浓硫酸:NH+HSO=(NH)SO(不产生白烟)挥发性酸(HCl、HNO等)遇氨气均有白烟生成;难挥发性酸(HSO、HPO)无此现象。NH+HNO=NHNONH+HSO=(NH)SONH+HCl=NHCl白烟NH能不能用浓硫酸干燥?不能氨气与酸反应一般生成相应的铵盐。NH+H+=NH+(与酸反应的本质)(D)氨的催化氧化(具有还原性)NH+ONO+HO催化剂e_思考:n(氧化剂):n(还原剂)=:(工业制硝酸的基础)(C)氨与某些盐反应NHHO+AlCl==Al(OH)↓+NHClNNHONOONOHOHNO氨经一系
狠狠的干小日本