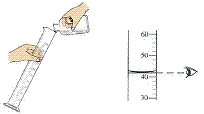
和胶头滴管。正确读取示数的方法是视线与量筒内液体的凹液面的最低处保持

药品的存放:
1、一般固体药品放在广口瓶中,液体药品放在细口瓶中(少量的液体药品可放在滴瓶中)。
2、见光易分解的药品需保存在棕色试剂瓶中:如硝酸,次氯酸等。
3、与空气反应容易变质的药品须密封保存:如:氢氧化钠,氯化亚铁等。
4、试剂摆放时氧化剂与还原剂分开,酸与碱分开。
分类拓展:
1.酸类实验室常用的三大强酸(盐酸、硫酸和硝酸)都有很强的腐蚀性,储存和使用时要特别注意安全。
(1)浓盐酸:容易挥发,应密封存放在阴凉处。
(2)浓硫酸:易吸水,会腐蚀橡胶塞,因此应密封保存在具有玻璃塞的细口瓶里。
(3)浓硝酸:易挥发,见光易分解,硝酸具有强腐蚀性,不能使用橡胶塞,应密封保存在具有玻璃塞的棕色细口瓶内,并且放在阴凉处。
2.碱类
(1)烧碱(氢氧化钠):易吸收水蒸气而潮解;吸收二氧化碳发生化学变化:2NaOH+CO2=Na2CO3+ H2O,所以要密封保存。若把氢氧化钠溶液保存在玻璃瓶中,烧碱易腐蚀玻璃,一定要选用橡胶塞而不是玻璃塞,以免瓶塞跟瓶体黏在一起,不便打开。

(2)熟石灰(氧氧化钙):易吸收二氧化碳而变质,要密封保存在塑料瓶中。Ca(OH)2+CO2=CaCO3↓ +H2O。
(3)碱石灰(氧化钙与氢氧化钠的混合物):可以作干燥剂,要密封保存,理由同上。
为防止氢氧化钠吸收空气中的水份及二氧化碳,存放时应密封保存。上层清液澄清石灰水可以检验二氧化碳,下层浑浊液体石灰乳是一种建筑材料。在空气中极易吸收水及二氧化碳.氢氧化锂有强的腐蚀性及刺激性,应密封保存.。
(5)氨水:易挥发、易分解,密封保存在棕色试剂瓶中.且置于阴凉处。
3.盐类
(1)硝酸银:见光、受热易分解,应密封于棕色瓶内或用黑纸包裹,置于阴凉处保存。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。漂水呈碱性,当遇热、遇光、遇还原性物质、遇有机物易爆炸分解,属于强氧化剂类危险品,在光合作用下迅速分解成氯化钠、氯酸钠和氧气,次氯酸钠在水中ph值大于6.5时就开始电离分解成大量na+(钠离子)和cio_(次氯酸根),在碱性环境下, 次氯酸根杀生效果很差,只有次氯酸的1%,显然如果能稳定次氯酸,使其不能离解为次氯酸根,则杀菌效果可以增加99倍。 一方面褐煤的有机质分解, 另一方面分解产物又相互缩聚, 生成分子量更大的物质, 同时产生一些气态物质如子量更大的物质, 同时产生一些气态物质如co2碳含量增高, 氧和氢含量减低, 缩合芳环的个数增加。
(3)无水氯化钙:易吸水而潮解,应密封保存,以免失效。
(4)高锰酸钾:是强氧化剂,应与易燃物(炭粉、硫黄、磷、酒精)分开存放。
4.单质
储存注意事项: 储存于阴凉、通风的库房.远离火种、热源.保持容器密封.应与氧化剂分开存放,切忌混储.采用防爆型照明、通风设施.禁止使用易产生火花的机械设备和工具.储区应备有泄漏应急处理设备和合适的收容材料.。2:需要存放在通风、干燥、远离火种及电源处。此种切割方法是用气体和氧气火焰把钢加热到易燃点,然后在氧气切割流中燃烧。
(2)钾、钙、钠的活动性很强,不能跟空气、水接触,所以要保存在煤油中,以免跟空气、水接触而燃烧,甚至爆炸。

(3)碘:受热时易升华,必须保存在棕色瓶中,且存放存阴凉处。
5.其他类
(1)双氧水(过氧化氢):受热易分解,密封保存且置十阴凉处。
介轻钙粉又称轻质碳酸钙 轻钙粉,是将石灰石等原料段烧生成石灰(主要成分为氧化钙)和二氧化碳,再加水消化石灰生成石灰乳(主要成分为氢氧化钙)液体药品的取用方法,然后再通入二氧化碳碳化石灰乳生成碳酸钙沉淀,最后经脱水、干燥和粉碎而制得,或者先用碳酸钠和氯化钙进行复分解反应生成碳酸钙沉淀,然后经脱水、干燥和粉碎而制得。轻钙粉,是将石灰石等原料段烧生成石灰(主要成分为氧化钙)和二氧化碳,再加水消化石灰生成石灰乳(主要成分为氢氧化钙),然后再通入二氧化碳碳化石灰乳生成碳酸钙沉淀液体药品的取用方法,经脱水、干燥和粉碎而制得,其主要原料是石灰石。在食品密封包装时,同时放入能除去包装内的氧化物质,除去包装容器中有力氧和溶存氧,防止食品由于氧化而发霉、变质等。
CaO+H2O==Ca(OH)2; Ca(OH)2+CO2==CaCO3↓+H2O。
(3)有机溶剂(如酒精、乙醚等):易燃烧,单独存放.密封保存于阴凉处。
药品的取用原则:
不要鼻子凑到容器口去闻气体的气味,更不能尝结晶的味道。不要鼻子凑到容器口去闻气体的气味,更不能尝。不能把鼻孔凑到容器口去闻药品的气味。
若没有说明用量,一般应按最少量取用:液体取l~2 ml,固体只需盖满试管底部。(1)实验室里所用的药品,很多是易燃、易爆、有腐蚀性或有毒的.因此在使用时一定要严格遵照有关规定和操作规程,保证安全.不能用手接触药品,不要把鼻孔凑到容器口去闻药品(特别是气体)的气味,不得尝任何药品的味道.注意节约药品,严格按照实验规定的用量取用药品.如果没有说明用量,一般应按最少量取用:液体l-2ml,固体只需要盖满试管底部.实验剩余的药品既不能放回原瓶,也不要随意丢弃,更不要拿出实验室,要放人指定的容器内.。(2)做加热时较多量的液体之间、固体和液体之间反应的容器,但液体量不得超过烧杯容器的1/2。
第二件,学会了配置许多的试剂,于是知道了不同的试剂配置需要注意的问题,巩固了某些药品相关的知识,并且在多次配置时,得出了一个结论:如果不是很熟悉的试剂配方,最好是拿一个专门的本子记录下来,以备不时之需,这样一来,以后实验也不会因为试剂的问题而手忙脚乱。四、实验材料与器具1、实验材料:香樟叶2、实验试剂:蒸馏水、nacl固体、无水硫酸钠3、实验器具:精油提取器、1000ml蒸馏烧瓶、蒸馏头、尾接管、接收瓶、温度计套管、蛇形冷凝管、出入水管、温度计、注射器。把块状的药品或密度较大的金属颗粒放入玻璃容器时,应该先把容器横放,把药品或金属颗粒放入容器口以后,再把容器慢慢地竖立起来,使药品或金属颗粒缓缓地滑到容器的底部,以免打破容器。
药品取用对比分析:
1、同体药品的取用
①取用粉末、颗粒状药品应使用药匙或纸槽,步骤:“一横、二送、三直立”,即将试管横放,用药匙或纸槽将药品送人试管底部(如下图所示),再把试管直立起来,让药品滑入试管底部。

②取用块状药品或较大的金属颗粒时应用镊子夹取,步骤:“一横、二放、三慢竖”,即先将试管(或容器) 横放,把药品放人试管(或容器)口以后(如下图所示),再把试管(或容器)慢慢竖立起来,使块状固体缓慢地滑到试管底部,防止打破试管(或容器)底。

2、液体药品的取用
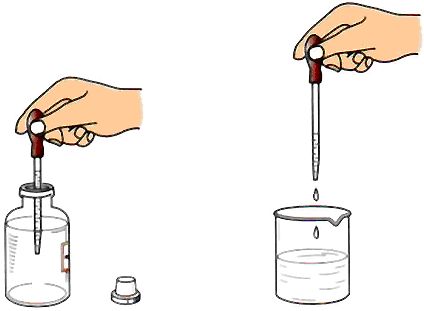
①滴管吸取法:取少量液体时,可用胶头滴管吸取 (如下图所示)。

然后拿起瓶子,瓶口要紧挨着试管口(图3),使液体缓缓地倒入试管。2、试管中的液体加热时,不要用手拿,应该用 夹住试管的 部,试管与桌面成 倾斜,试管口不准对着自己或别人,先加热试管的 部,慢慢地移动试管热及____部,然后不时地______试管,从而使试管各部分受热均匀。③手拿试剂瓶倾斜液体试剂时,应让标签向上对着手心。

3、定量取用药品
b.用天平称量物质时要左物右码,对于有腐蚀性的药品应该放在烧杯等容器内称量,以免腐蚀天平。称前调零点,称量时左物右码,精确至0.1克,药品不能直接放在托盘上(两盘各放一大小相同的纸片),易潮解、腐蚀性药品放在玻璃器皿中(如烧杯等)中称量。6、药品不能直接放:意思是说被称量的药品不能直接放在托盘上(联想:可在两个托盘上各放一张大小相同的纸片,然后把被称量的药品放在纸片上,潮湿或具有腐蚀性的药品必须放在表面皿或烧杯里称量)。
②液体的量取。根据被量液体的体积选择合适规格的量筒。“使用量筒先放平,量简刻度没有零,视线与凹液最低点,保持一致方可行”。
注意事项:
1、不能用手接触药品、不能直接闻气体、不能尝药品的味道。
2、块状固体:用镊子夹持,将试管平放,用镊子将块状固体放入试管中,然后慢慢将试管竖起,
使块状固体慢慢滑入试管底部,防止打破试管底
3、粉末状固体:将试管倾斜,把盛有药品的药匙或纸槽送入试管底部,然后将试管直立起来,
让药品落入底部
4、液体药品:取下瓶塞倒放在桌面上,标签握在手心里,口口相挨免外流,试管略倾便操作。
取液后的滴管应保持橡胶胶帽在上,不要平放或倒置,防止液体倒流,沾污试剂或腐蚀橡胶胶帽。用过的滴管要立即用清水冲洗干净(滴瓶上的滴管不要用水冲洗)。等胶干了,玻璃贴片不动以后,及时用洗衣粉和刷子加少量清水将其刷净,在用清水冲洗干净。
节约原则:
没有说明药品用量时,液体药品一般取用1—2mL,固体药品一般以盖满试管底部为原则。
防污染原则:
取用后多余的药品不能放回试剂瓶;胶头滴管滴加药品时,不能倒置,也不能将胶头滴
管的尖嘴伸入仪器口内。用过的药匙、镊子应该用滤纸等擦干净以备用。粉末药品应用纸条取用。
靠发股发财