元素周期表的发现及发展史(2)
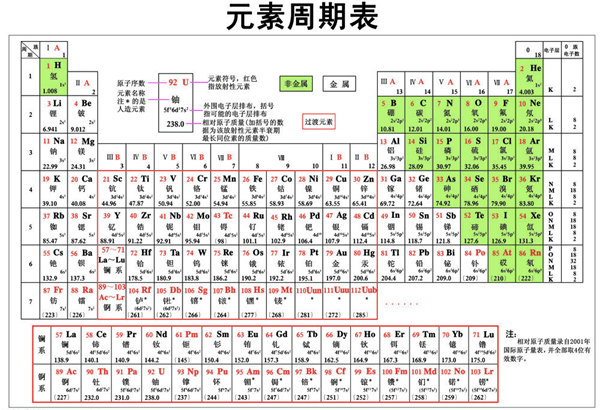
失电子能力逐渐减弱, 获电子能力逐渐增强,金属性逐渐减弱, 非金属性逐渐增强。 元素的最高正氧化数从左到右递增(没有正价的除外), 最低负氧化数从左到右递增(第一周期除外, 第二周期的 O、 F元素除外)。同一族中, 由上而下, 最外层电子数相同, 核外电子层数逐渐增多, 原子序数递增, 元素金属性递增, 非金属性递减。元素周期表的意义重大, 科学家正是用此来寻找新型元素及化合物。五、 教科书中的元素周期表 这些图片不过是我们常见的在普通不过的元素周期表了, 它们能够以最简洁的方式告诉我们所要查找的一部分, 具有简便, 清楚的特点。六、 其他形式的元素周期表 1.漫画周期表 看, 多生动活泼的漫画式元素周期表啊! 对理解化学元素的性质多有帮助! 看那个卤族上面坐着的两个氢原子, 紧盯着下面得到一个电子形成稳定结构的得意的氟原子, 其中一个向另一个哭诉: “他偷走了我的唯一一个电子, 现在我只剩下一个原子核了! ”(我猜是这个意思) 别的元素的原子之间的对白也十分有趣。 是呀, 氟是元素周期表主族元素中非金属性最强的了 , 与氢化合是最容易的! 2.钟表式周期表3.柱式周期表(现在看看越来越不像周期表了)4.层叠式(右下角那个, 是坐标吗? )5.环式 6.螺旋式 7.透视式8.三角形式9.配图式 10.门捷列夫早期的元素周期表11.圆柱式12.建筑群式 13.螺旋时钟式14.塔式15.笔筒式16. 树形17.六边形式第三部分: 小组成员汇报、 反思 冯国忠: 在本次研究性学习中, 我们组的主题是元素周期表的发展和演变。
从中我们通过到学校、 家里、 市区图书馆或网上搜索所需资料的方法学到了一些元素周期表的历史及了解了 贝莱那, 门捷列夫等发明者对元素周期表的贡献。 学习化学有整整两年了, 作为学习化学时刻需要的工具——元素周期表对我们的学习作用非常的大。元素周期表是世界化学历史上重要的一部分, 对世界的科技进步也起到了 一定作用。 作为中学生的我们, 要向那些伟大的科学家们学习, 学习他们的有恒心, 有毅力的美好品质。 在化学史上, 我们应该以他们为榜样, 努力学习科学文化知识, 不断充实自己, 多观察, 多动手实践, 这样我们在学习生活中才能有所成就。通过这次研学, 我觉得我们调查速度和小组分工合作比上一次默契了许多, 希望下次依旧这么有行动力。 陶俊宏: 这次应该是最后一个课题了 吧, 本来第一次接触研究性课题的时候感觉还挺新鲜的, 后来的几次课题让我觉得这个挺麻烦的, 这次的对后一个课题完成后, 感觉又有点不舍。刚开始的打算是希望通过此活动, 使同学们能够进一步了解元素周期表的历史和用途, 并对同学们日 后的化学学习起到帮助, 了 解元素周期表的历史、 发展过程和它的发现者。
在化学学习中能够有一些帮助。 化学我们也学了 这么长时间了 , 元素周期表的重要性大家都知道, 这次跟它有关的课题也比较贴近我们高中生的学习生活。 和以前一样, 大家都在领了任务后积极完成中, 每个同学都认真参加组内项目, 认真组织并且配合组长工作, 所以我们小组的进度算是比较快的了。 在每个研究性课题完成后, 我们都能够学到很多有用的东西, 在整理过程中体会到了团结的力量, 众人拾柴火焰高, 一个人的力量是很有限的, 通过团队合理的分工安排可以减少很多不必要的时间损失, 这对于我们学会合作, 运用合作是难能可贵的一个机会。 这次研究性学习不但给我带来了 美好的回忆, 并且收获中我还学会了一些做人, 做事的基本道理。 对于我们来说, 还有很多的不足之 处, 但是我们还有机会再慢慢改进, 重要的是我们已经认识到了 。 在以后的学习和生活中, 我还要加强提高自己的综合素质, 得到精神的成长。 陈赐 : 我去们这次的研学是‘关于元素周期表的形成过程’ 为主要线索展开调查的。 也许大多数同学都知道元素周期表, 但对它是如何产生的一无所知。 所以为了满足大家的需要, 增加我们的课外知识, 我们这阻绝为大家服务, 让同学对元素周期表的形成过程有更深刻的认识。
通查资料搜集信息, 我们发现门捷列夫发现并完成元素周期表的制作并不是一帆风顺的。 在这期间他进行大量的猜测, 重新测定一些认为不对的元素的原子量, 收到当时人的争论, 但他坚信实验是检验真理的唯一标准。 他的坚持不懈大胆猜疑科学的实践证明他发现的元素周期律是自然界的一条客观规律。 它作为描述元素及其性质基本理论有力的促进了 现代化学和物理化学的发展。 现代的我们也要有这种敢于创新、 大胆实践的能力, 要敢于挑战真理, 我们每个人都有可能成为下一个‘门捷列夫’。 李宜瑾: 关于这次研学, 我有了不一样的体会, 关于这次的主题, 是关于元素周期表, 是一次将学习与实践结合在一起的研学主题。首先, 研学的主题给人一种耳目一新的感觉, 会让人提起兴趣来做,这就增加了 研学的成功率, 但是同时还有一点就是, 让人觉得有压力,不自觉的想要放弃这次的研学, 这一点不太好……其次, 就内容来说, 道出了 元素周期表和周期律的重要性, 让人体会到化学的奇妙, 使人对化学产生兴趣, 也让人对元素周期表和周期律的发展历史更加的了 解, 同时还能了 解到很多化学家的故事, 对学生的素质教育提供了 很好的素材, 励志了 学生, 为学生更加努力的学习提供了动力, 这一点很好!还有对人员分工及时间分布安排, 时间有点仓促, 令人对研学主题不能很深入的了 解以及对研学的调查方面不能很好的切入到调查对象中去, 这一点做得不是很好! 希望下一次可以更好地完善!最后, 我希望这次研学带给我们的不只是研学而已, 更希望它带给我们的还有启发! 还希望以后我们的希望不下仅仅只是希望而已, 希望可以变成现实让我们去幸福!!!第四部分: 分析总结在本次研究性学习 中, 我们的课题为: 元素周期表的发展和演变。
一款家电产品从设计研发到投入市场通常只要一两年时间,但科技业务产品研发周期、市场培育周期却要漫长的多,投资风险也更大。周期:具有相同电子层数的元素,按照原子序数递增的顺序从左到右排列的一行,叫周期。②只有元素完全相同,并且元素的排列顺序也完全相同时,两个排列才是同一个排列,元素完全相同,但排列顺序不一样或元素不完全相同,排列顺序相同的排列,都不是同一个排列。
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。e是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )a.a、b、c、d、e b.e、c、d、b、a c.b、a、d、c、e d.c、d、a、b、e5.下列各组顺序的排列不正确的是( )a.离子半径:f->na+>mg2+>al3+ b.热稳定性:hcl>h2s>ph3>ash3c.酸性强弱:h3alo3<h2sio3<h2co3<h3po4 d.溶点:金刚石>na>sio2>co26.某元素原子的质量数为a,它的阴离子xn-核外有x个电子,w克这种元素的原子核内中子数为( )a. b.c. d.7.某主族元素r的最高正价与最低负化合价的代数和为4,由此可以判断( )a.r一定是第四周期元素 b.r一定是Ⅳa族元素c.r的气态氢化物比同周期其他元素气态氢化物稳定d.r气态氢化物化学式为h2r8. 元素x和元素y在周期表中位于相邻的两个周期,x和y两原子核外电子总数之和为19,y原子核内质子数比x多3个,下列叙述正确的是( )a.x和y都是性质活泼的元素,在自然界中只能以化合态存在b.x和y形成的化合物的化学式为y2xc. y的化合物种类比x的化合物种类多d.y能置换酸中氢,放出氢气,但不能置换出盐中的金属9. 运用元素周期律分析下面的推断,其中不正确的是( )。(2)位于第二周期的某元素的原子核外p电子数比s电子数多1个,该元素是表中的_____(填编号),该元素与元素 ⑤ 形成的化合物的电子式是_______________,其中的化学键是__________键。
呵呵