元素周期表的发展历程
现代化学的元素周期律是1869年俄国科学家门捷列夫(dmitri mendeleev)首创的,他将当时已知的63种元素依相对原子质量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的雏形。按这个规定,下列说法中正确的是a.第3列元素种类最多,第14列元素形成的化合物种类最多b.第8、9、10三列元素中没有非金属元素c.从上到下第17列元素的单质熔点逐渐降低d.只有第2列元素的原子最外层有2个电子8.下列各组顺序的排列不正确的是a.半径:na+ > mg2+ > al3+ > f。这就使晶界结构偏离理想重合位置点阵模型的原子排列,而由若干原子规则排列的单元周期分布在不规则排列的原子中,这些单元为有限的几种原子紧密排列的多面体。
原子半径由左到右依次减小,上到下依次增大。

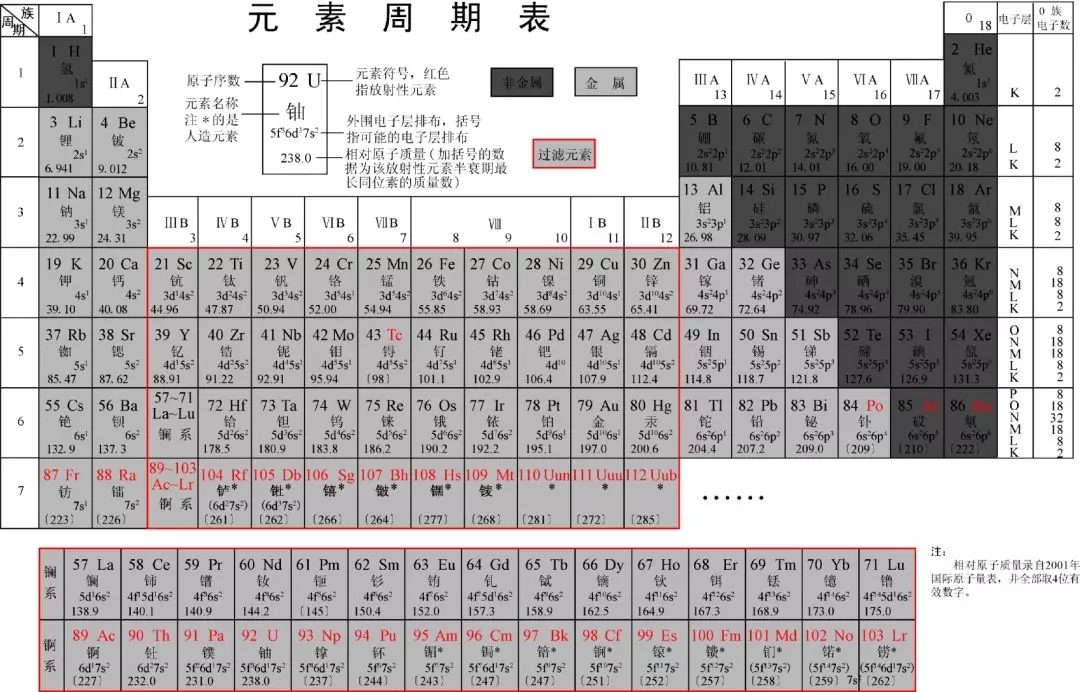
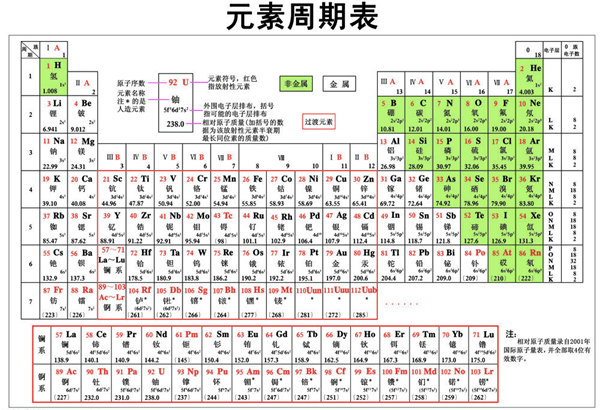
在化学教科书和字典中,都附有一张“元素周期表(英文:the periodic table)”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。随着科学的发展,元素周期表中未知元素留下的空位先后被填满。当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的质子数﹙核外电子数或核电荷数﹚,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数跟元素的原子结构有如下关系:

质子数=原子序数=核外电子数=核电荷数
利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。1913年英国科学家莫色勒利用阴极射线撞击金属产生射线X,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列。后来又经过多名科学家多年的修订才形成当代的周期表。

元素周期表中共有118种元素。将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。每一种元素都有一个序号,大小恰好等于该元素原子的核内质子数,这个序号称为原子序数。在周期表中,元素是以元素的原子序排列,最小的排行最前。表中一横行称为一个周期,一列称为一个族(8、9、10纵行为一个族)。 原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。共有16个族,又分为7个主族(ⅠAⅡA ⅢA ⅣA ⅤA ⅥA ⅦA), 7个副族(ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB),一个第Ⅷ族(包括三个纵行),一个零族。
4.掌握周期表各区、周期、族的原子核外电子排布规律及元素性质的递变规律。 练出高分 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 b 练出高分 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 a 练出高分 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 a 知识梳理 探究高考 练出高分 第1讲原子结构与性质 重难点:周期表各区、周期、族的原子核外电子排布规律及 元素性质的递变规律。3、了解同一周期、同一主族中元素电离能的变化规律,了解元素电离能和原子核外电子排布的关系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增元素周期表的发现史,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。15.短周期元素a、b、c的原子序数依次递增,它们的原子最外层电子数之和为11,a、c同主族,b原子最外层电子数比a原子次外层电子数多1。对同一元素的原子,由于核电荷不变,失去的电子越多,有效核电荷增加得越多,核对外层电子的吸引力越大,剩下的电子就越不容易失去,所以i1 元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。 2015年12月31日美国《科学新闻》双周刊网站发表了题为《四种元素在元素周期表上获得永久席位》的报道。国际纯粹与应用化学联合会(IUPAC)宣布俄罗斯和美国的研究团队已获得充分的证据,证明其发现了115、117和 118号元素。此外,该联合会已认可日本理化学研究所的科研人员发现了113号元素。两个研究团队通过让质量较轻的核子相互撞击,并跟踪其后产生的放射性超重元素的衰变情况,合成了上述四种元素。IUPAC执行理事林恩·瑟比说,有关确认新元素的报告将于2016年初公布。官方对这些元素的认可意味着它们的发现者有权为其命名并设计符号。113号元素将成为首个由亚洲研究人员发现并命名的元素。 命名新元素的国际纯粹与应用化学联合会认为。2.理学类:数学与应用数学、信息与计算科学、统计学、应用统计学、物理学、化学、心理学、生物科学等。热化学是研究化学反应热现象的科学元素周期表的发现史,曾为建立热力学第一定律(能量守恒和转换定律) 提供了实验依据,反过来,它又是热力学第一定律在化学反应中的具体应用。
错