2018学年高一下学期第一次4月月考化学试题

【题文】(1)Na2SiO3的水溶液俗称______________,是制备硅胶和木材防火剂的原料。
(2)许多人喜欢佩戴玉石饰品。玉石的主要成分基本属于硅酸盐,例如和田玉(Ca2Mg5H2Si8O24)可表示为氧化物形式2CaO·5MgO·8SiO2·H2O,则南阳玉(CaAl2Si2O8)表示为氧化物形式是________________。
(3)光导纤维在强碱性条件下容易发生“断路”,试用离子方程式解释其原因_____________________________________________。
(5)银和稀、浓硝酸反应,方程式分别为:3ag+4hno3(稀)=3agno3+no↑+2h2o,ag+2hno3(浓)=agno3+no2↑+2h2o,对比两方法:若同样生成3molagno3,用银和稀硝酸反应,消耗4molhno3,生成1molno,用银和浓硝酸反应高中化学喷泉实验,消耗6molhno3,生成3molno2高中化学喷泉实验,即生成等物质的量的agno3时,消耗稀硝酸比浓硝酸少,同时产生的污染气体少。分析:硫在氧气燃烧时能够发出蓝紫色火焰,生成一种有刺激性气味的气体二氧化硫,二氧化硫和水反应能生成亚硫酸,亚硫酸能被氧气氧化成硫酸。30.给氯化钠(固)与硫酸(浓)的混合物加热:有雾生成且有刺激性的气味生成。
难度:一般使用:107次加入试题篮收藏
【题文】从化合价的角度可以预测物质的性质
(1)从硫的化合价分析浓H2SO4的性质_____(填序号)。
A.只有还原性 B.只有氧化性 C.既有氧化性又有还原性
(2)SO2能使酸性高锰酸钾溶液褪色,反应结束后,硫元素的存在形式合理的是_____(填序号)。
A.S2- B.S C.SO32- D.SO42-

(3)若要将NH3→N2,,从氧化还原的角度分析,下列试剂可行的是_______(填序号)。
A.O2 B.Na C.NH4Cl D.NO2
(4)实验室只用一种物质将NO 直接转化为硝酸且绿色环保,则该物质的化学式为_____________。来源:福建省泉州市泉港区第一中学2017-2018学年高一年下学期第一次(4月)月考化学试题上传:2018-04-24
难度:一般使用:93次加入试题篮收藏
【题文】根据下列转化关系(部分反应条件及产物已略去),A、B、C、D中均含有同一种元素,回答下列问题:
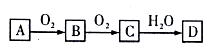
(1)若B是能使品红溶液褪色的气体,写出D的浓溶液与Cu在加热情况下反应的化学方程式_______________________________。
(2)若A是N2,则
①B转化为C的现象:_______________________________。
②写出过量Fe与D的稀溶液反应(还原产物只有B)的离子方程式_______________________________。

(3)若A是能使湿润的红色石蕊试纸变蓝的气体,则
①它与O2在高温、催化剂的作用下反应生成B,此化学方程式为
_______________________________。
(3)小李在实验室中用氯酸钾和另一种固体制取氧气,他选择上述装置中的a和或(填字母)进行组装.小红在实验室中选用c装置作为氧气的发生装置.在他们的实验中都用到了一种相同的固体药品是(填化学式),请你写出小红制取氧气的化学反应方程式:.。 ⑤交流总结:该反应的方程式为:____2h2o+o2↑ (2)天然气是一种常用的燃料,主要成分是甲烷.甲烷是一种无色、无味、密度比空气小、难溶于水的气体.实验室常用加热无水醋酸钠与碱石灰的固体混合物来制取,请你设计实验室制取甲烷的实验: ①明确实验目的:____。如讲《二氧化碳的实验室制法》一节时,教师可先让学生在气体实验室制取的思路和方法指导下,自学实验制取二氧化碳的反应原理、装置、制取等内容后,并提出能否用碳酸代替大理石,用硫酸代替稀酸制取二氧化碳,再让学生分组实验,仔细观察现象,引导学生讨论总结答案。
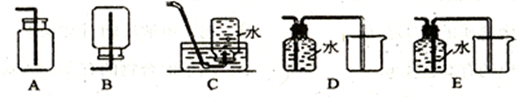
③若要收集B气体,下列收集装置中合适的是(填序号)______________。
④1.92g铜投入一定量D的浓溶液中,铜完全溶解,共收集到672mL气体(标准状况),则反应中消耗D 的物质的量为_____________。来源:福建省泉州市泉港区第一中学2017-2018学年高一年下学期第一次(4月)月考化学试题上传:2018-04-24
难度:一般使用:83次加入试题篮收藏
【题文】“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
由于天然气水合物中通常含有大量甲烷或其它碳氢气体,因此极易燃烧,被称为“可燃烧的冰”,燃烧产生的能量比同等条件下,煤、石油、天然气产生的都多得多,而且在燃烧以后几乎不产生任何残渣或废弃物,污染比煤、石油、天然气等要小得多。较高浓度的no2污染主要发生在用高温燃烧大量煤和石油的地方,此外,氮肥和火药工业也产生大量no2。脱硫是减少化石燃料(主要指煤)生成的so2排放到大气中的所有技术手段的通称,常见脱硫方法按照燃烧过程可以分为三类:⑴燃烧前清洁技术:煤炭洗选、煤气化、液化和水煤浆技术。

(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
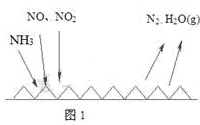
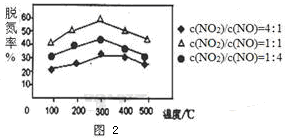
①由图1可知SCR技术中的氧化剂是__________________
②将“analog in 1/2”通道接通,分别点击图5对应位置标“x”的框,弹出钩选框后设置为钩,点击“close”关闭钩选框,如图6所示,选择完成后效果如图7所示。频特性 实 际系 统 的特 性 并不 理想, 一般 只 是在 一定频 率范 围 内满 足式 2 . 11 . 12 和 式 2 . 11. 13 , 如图 2 . 11. 3 和图 2 . 11. 4 所示。4.1实验测试中的关键代码与各模块测试结果的分析与说明1 创建一个弹出式主菜单下面代码是其设计界面的代码. 文本框1是界面代码, 文本框2是获取键盘方向代码.效果如图2所示:文本框1文本框2图2图32 实现光标的上移和下移,其代码文本框3所示, 其效果,请对比图2和图3.文本框33 在循环链表里输入数据,其实现代码如文本框4所示,效果如图4所示.文本框4图44 进入约瑟夫环问题的数据处理.其实现代码如文本框5所示,效果如图5所示:文本框5图53 查看已储存的数据.其代码如文本框6所示,其效果如图6所示:文本框6图63 查看约瑟夫环问题的内容:其效果如图7所示:图74.2试验过程中所遇到的问题分析与解决问题一:在创建弹出式菜单时,光标的上移和下移,无法实现.解决方案:将弹出式菜单的教程重新看了一遍,里面的光标上移和下移,都是通过各个坐标来实现的,例如window 3,3,29,9 。
(3)某工厂拟综合处理含NH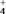 废水和工业废气(主要含N2、Cl2、NO),设计了如下流程:
废水和工业废气(主要含N2、Cl2、NO),设计了如下流程:
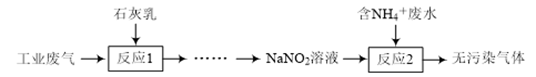
“反应2”的离子方程式为________________________________。来源:福建省泉州市泉港区第一中学2017-2018学年高一年下学期第一次(4月)月考化学试题上传:2018-04-24
难度:一般使用:110次加入试题篮收藏
【题文】某研究性学习小组学生用图中所示装置(部分夹持装置略)探究NO与Na2O2反应的情况,提出假设并进行相关实验。
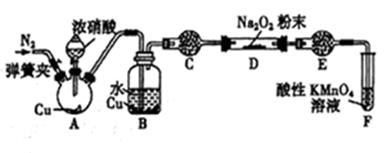

该研究性学习小组同学认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(1)在反应前,打开弹簧夹,通入一段时间N2,目的是__________________________。
(2)A 中反应的氧化剂与还原剂的物质的量之比为______________。
(3)B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生
(4)C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
(1)kclo3→kclo4+kcl(2)ca5 po4 f+c+sio2→casio3+caf2+p4+co (3)nano2+nh4cl→n2+nacl+h2o (4)k2cr2o7+feso4+h2so4→cr2 so4 3+fe2 so4 3+k2so4+h2o (5)cscl+ca→cacl2+cs↑11-2 将下列水溶液化学反应的方程式先改写为离子方程式,然后分解为两个半反应式(答案见附表电极电势表):(1)2h2o2 2h2o+o2(2)cl2+2h2o hcl+hclo(3)3cl2+6koh kclo3+5kc+3h2o (4)2kmno4+10feso4+8h2so4 k2so4+5fe2 so4 3 +5mnso4+8h2o (5)k2cr2o7+3h2o2+4h2so4 k2so4+cr2 so4 3+3o2+7h2o11-3 用半反应法(离子-电子法)配平下列方程式:(1)k2cr2o7+h2s+h2so4→k2so4 +cr2 so4 3 +s+h2o(2)mno42-+h2o2→o2+mn2- 酸性溶液 (3)zn+no3-+oh-→nh3+zn oh 4- (4)cr oh 42-+h2o2→cro 42- (5)hg+no3-+h+→hg22++no11-4将下列反应设计成原电池,用标准电极电势判断标准下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号。经过分析,习题“a、b、c、d是短周期元素形成的四种气体单质.e、f均为气体,且f为红棕色.有关的转化关系如图所示(反应条件均已略去).请回答下列问题:(1)d的化学式为____.(2)反应③的离子方程式为____.(3)y和e在一定条件下可反应生成b和z,这是一个具有实际意义的反应,可消除e对环境的污染,该反应的化学方程式为____.(4)0.1mol•l-1的x溶液和0.1mol•l-1的y溶液等体积混合,溶液呈____性(填“酸”、“碱”或“中”),原因是____(用离子方程式说明).(5)常温下0.1mol•l-1的y溶液中c(h+)/c(oh-)=1×。(3)对比e、g的结构,由g可倒推f的结构,然后根据取代反应的基本规律,可得反应方程式,吡啶是碱,可以消耗反应产物hcl。
(6)充分反应后,检验D装置中产物的方法是: _____________________________ ,则产物是NaNO2。来源:福建省泉州市泉港区第一中学2017-2018学年高一年下学期第一次(4月)月考化学试题上传:2018-04-24
难度:一般使用:32次加入试题篮收藏
那不是对你秀的