如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液(

3、全自动工业水洗机加剂结束后,加剂舱口能关闭,防止加剂舱口在转笼运转时溢出化学洗涤剂。 本方向开展各种纳米催化新材料的研制如非晶态合金催化 剂、稀土钙钛矿型、尖晶石型复合新催化材料、碳纳米管的合成 以及以碳纳米管为载体的催化剂等研究。在有机硅类流平剂手感剂剂上非常有特点,代表产品dc51.,海名斯特殊化学公司于2008年7月并购德谦企业,定位为一家专注于客户与市场所需的驱动技术,并以提供高性能化学方案解决与技术服务为核心能力的公司。
化学键
键能/kJ•mol-1
反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=-178 kJ•mol-1,△S<0(填>,<,=)
(3)①依据实验步骤可知步骤d是验证cu+可与浓氨水反应生成cu(nh3)2+(无色),该无色物质在空气中易被氧化变为蓝色,所以步骤c是验证白色沉淀可能是cucl,检验反应后的溶液中是否含氯离子,步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液,观察是否生成白色沉淀判断氯离子的存在,。④加足量bacl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色.。分析:根据硫酸铜溶液是蓝色,硫酸钡和碳酸钡是白色沉淀.碳酸钡是溶于稀硝酸的,而硫酸钡不溶于稀硝酸的特性进行分析解答.。
12.下列说法正确的是()
 的名称为3,6-二乙基-1-庚醇
的名称为3,6-二乙基-1-庚醇
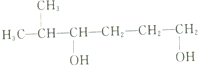 的名称为2-甲基-3,6-己二醇
的名称为2-甲基-3,6-己二醇
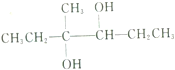 的名称为4-甲基-2,4-己二醇
的名称为4-甲基-2,4-己二醇
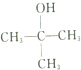 的名称为2-甲基-2-丙醇
的名称为2-甲基-2-丙醇
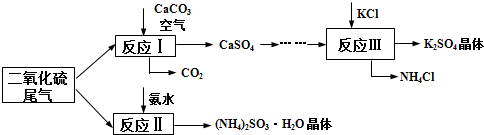
9.研究SO2等大气污染气体的处理具有重要意义.

Ⅰ.以硫酸工艺的尾气、氨水、石灰石等原料可以合成K2SO4晶体、(NH4)2SO3•H2O等物质.合成路线如下:
将碳酸钙高温煅烧,生成氧化钙和二氧化碳,反应方程式:caco3=高温=ca0+co2↑。6.化学将23克碳与60克石灰石在高温下发生反应,产生的气体在标准状(气体,高温,石灰石,化学,标准状况,高温反应,物质的量)。 4.7 完成下列反应: hbrch 高温cl clcl cl cl 高温c(ch chch clcl 4.8 写出反-1-甲基-3-异丙基环己烷及顺-1-甲基-4-异丙基环己烷的可能椅式构象。
(2)反应Ⅱ中需要向溶液中加入适量的对苯二酚,其作用是B(选填序号).
A.使SO2更易被氨水吸收B.防止(NH4)2SO3被氧化C.防止生成NH4HSO3
6.蒸发和结晶 蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法.结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物.结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出.加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅.当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离nacl和kno3混合物.。i、蒸发和结晶 蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法.结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物.结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出.加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅.当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离nacl和kno3混合物.。该反应的生成物为mg(clo2)2和nacl的混合溶液,nacl的溶解度随温度变化不大,mg(clo2)2的溶解度随温度升高而升高,利用两物质的溶解度差异,通过加热蒸发浓缩,冷却结晶,过滤,将mg(clo2)2与nacl分离,制得mg(clo2)2。
1.氨水法:将氨水配制成一定比重和碱度的溶液,循环吸收制硫酸尾气或焚硫烟气中二氧化硫,制得亚硫酸氢铵溶液,当吸收液相对密度达到1.30~1.32时送入中和器,再加入氨水中和反应至终点,经离心分离、干燥,制得亚硫酸铵成品。为了提高成功率高中化学喷泉实验,实验前在乙醛的聚合物中加入少量硫酸并加热蒸馏高中化学喷泉实验,馏出物用水吸收,既得乙醛溶液,可用于做银镜实验。2.碳酸氢铵法:用母液或氨水吸收溶液吸收制硫酸尾气中二氧化硫,制得亚硫酸氢铵溶液,当吸收液相对密度达到1.30~1.32时送入中和器,再加入碳酸氢铵中和反应至终点,经离心分离、干燥,制得亚硫酸铵成品。
Ⅱ.用如图所示装置制取SO2并探究SO2和Fe(NO3)3溶液的反应.已知:1.0mol/L的Fe(NO3)3溶液pH=1.
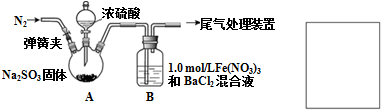
请回答:
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.

(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)反应开始后,装置B中产生白色沉淀,白色沉淀的成分是BaSO4,产生白色沉淀的原因有两种观点:
观点1:SO2与Fe3+反应.
观点2:酸性条件下,SO2与NO3-反应.
关键词:漂白粉、碘量法、有效氯目作文一、前言 二、测定方法原理 三、试剂和溶液 四、仪器 五、实验步骤 8.1 试剂溶液的制备 8.2 有效氯的测定 8.3 原始数据的记录 8.4 结果计算 8.5 误差分析 六、实验过程中的讨论 七、注意事项 八、参考资料录一、前言漂白粉是什么。1.5精密度实验:取铜、锰、铁、锌、钙、镁的对照品溶液,分别连续测定6次,计算rsd,结果rsd分别为铜0.5%、锰0.3%、铁0.4%、锌0.2%、钙0.5%、镁0.3%。1.9加样回收率实验:精密称取2号紫花地丁药材粉末0.5g共9份,分别加入铜、锰、铁、锌、钙、镁的标准溶液,制备成高、中、低三个浓度的样品,每个浓度3份,按2.3.2的方法进行消化,按2.3.3的方法配制成待测样品溶液,分别测定铜、锰、铁、锌、钙、镁的含量,计算回收率。
(4)为保证安全,在A、B两装置间添加防倒吸装置,请在方框中画出装置图.
16.下列关于H2S分子的化学用语正确的是()

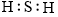



6.回答下列各问题:
(1)光谱证实单质Al与强碱溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在acd(填字母).
a.极性共价键b.非极性共价键c.配位键d.σ键e.π键
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C,Si,H的电负性由大到小的顺序为C>H>Si.
(3)Fe和Mn两元素的部分电离能数据如表:
元 素
电离能
(kJ•mol-1)
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.其原因是Mn2+的3d轨道电子排布为半满状态较稳定;
半径要看清模型:氯原子的半径小于氯离子半径,钠原子半径大于氯原子半径,钠离子半径小于氯离子半径。8、大圆半径是8厘米,小圆半径是7厘米,小圆与大圆面积的比是()9、圆的半径增加2厘米,则圆的周长增加()厘米10、圆周率π()(填大于,小于、等于)3.14。16、大圆半径是8厘米,小圆半径是7厘米,小圆与大圆面积的比是()17、圆的半径增加2厘米,则圆的周长增加()厘米18、圆周率π()(填大于,小于、等于)3.14。
(5)H2S和H2O2的主要物理性质比较如下:

熔点/K
沸点/K
标准状况时在水中的溶解度
以任意比互溶
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子间存在氢键,与水分子可形成氢键.
13.下列离子方程式正确的是()
硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO⒋↓
稀硫酸中加入铜片:Cu+2H+=Cu2++H2↑
氧化铜溶于盐酸:O2-+2H+=H2O
二氧化碳通入足量澄清石灰水:Ca2++2OHˉ+CO2=CaCO3↓+H2O
10.等质量的下列物质在常温常压下体积最大的是()
浓硫酸
铁粉
冰水混合物
让那些光棍跟你爸合伙用你妈