高中化学第四章第4节第1课时氨的性质与制法课件新人教版


1、的主要原因。本课时我们就学习氮元素形成的重要化合物氨及铵盐各有哪些重要性质和用途?实验室里又是如何制备氨气的呢?新知识•预习探究●学习目标.了解氨的性质及应用。.理解喷泉实验的原理。.掌握氨气的实验室制法。.了解铵盐的性质及NH+的检验。●新知预习.在自然界中,氨是动物体特别是蛋白质腐败的产物。工业制取氨的反应为_______________________。它是没有颜色、有________气味的气体。氨的密度比空气________。氨________溶解于水。在常温下,体积水大约可溶解________体积氨气。氨的水溶液叫做________。.氨溶于水时,大部分与水结合成________(NHHO),NHHO可以小部分电离成NH+和OH-,所以氨水显弱碱性,能使酚酞溶液变红。氨在水中的反应可用下式表示:NH+HONHHONH++OH-。N+H高温、高压催化剂NH刺激性小极易氨水一水。
2、成才之路化学路漫漫其修远兮吾将上下而求索人教版必修非金属及其化合物第四章第四节氨硝酸硫酸第四章第课时氨的性质与制法第四章新情境•激趣入题新知识•预习探究新思维•名师讲堂新考题•随堂自测新提升•达标作业新视点•专家博客新情境•激趣入题俗话说:“庄稼一枝花,全靠肥当家。”氮元素是蛋白质的主要成分,是植物生长所必需的首要营养元素。植物需要氮肥,犹如人体需要蛋白质一样。但是世界上大多数地区的土壤中都缺乏氮素养分,为了获取农作物高产,需要施用大量氮肥。具有固氮能力的生物,本身就是一座小化肥厂。这个化肥厂的原料来自空气,取之不尽,这种化肥厂不需要厂房和设备,不污染环境,能源则是用之不竭的太阳能。如果让玉米、小麦、水稻等作物都具有固氮能力,不再施用化肥,那就建造了许许多多这样的“天然化肥厂”。用它来取代目前的化学肥料工厂,其经济效益、社会效益是十分明显的。这也正是生物固氮遗传工程所要解决的问题和其成为热门研究课题。
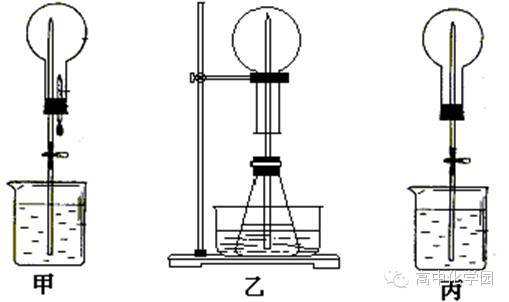
3、存在压强差。●典例透析()实验室制取氨气的化学方程式:_________________。①用图装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是__________。该实验的原理是_______。②如果只提供如图的装置,请说明引发喷泉的方法________________________。()利用图装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________。A.Cu与稀盐酸B.NaHCO溶液与NaOH溶液C.CaCO与稀HSOD.NHHCO与稀盐酸()在图锥形瓶中加入酒精,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是________。A.浓硫酸B.食盐C.硝酸钾D.硫酸铜()从产生喷泉的原理分析,图、是________上部烧瓶内的压强。图是________下部锥形瓶内气体的压强(均填“增大”或“减小”)。人造喷泉及火。
4、===(NH)SO氨气只与挥发性酸反应有白烟产生,遇难挥发性酸无此现象,这可作为检验氨的方法之一。()氨的催化氧化(表现还原性)氨气跟空气中的氧气反应发生催化氧化或接触氧化;NH+O高温催化剂NO+HO温馨提示:①氨不仅能跟盐酸反应,也能跟硫酸、硝酸、醋酸、碳酸等多种酸反应,反应实质都是NH与H+的反应。因为氨易跟酸反应生成盐,所以不能用浓硫酸作氨气的干燥剂。同理,氨气与氯化氢气体不能共存。②在中学化学中NH是唯一能与酸反应生成盐的气体。③气态氢化物与最高价氧化物所对应水化物发生化合反应,这是氮元素有别于其他元素的特征。④在该实验中,只有浓硝酸、浓盐酸等挥发性酸遇NH才会产生白烟,硫酸、磷酸等难挥发性酸遇NH不产生白烟现象。.氨的用途()工业上用于制化肥,如(NH)SO、NHHCO、NHNO等。()有机合成的重要化工原料。()作制冷剂。(经典习题选萃)喷泉是一种常见的自然现象,其产生的原因是。
5、在降温或加压条件下,气态氨液化成无色液体,同时放出大量的热,液氨汽化时要吸收大量的热,使周围物质的温度急剧下降,因此常被用作制冷剂。()密度小:用向下排空气法收集。()喷泉实验①在干燥的圆底烧瓶里充满氨气,用带有玻璃管的塞子塞紧瓶口。②倒置烧瓶,使玻璃管插入盛有水的烧杯中。③轻轻挤压滴管,使少量的水进入烧瓶。④打开止水夹结论:NH极易溶于水,挤入滴管内的少许水,可以吸收烧瓶中的大量NH,烧瓶内气压迅速减小,打开止水夹,烧杯内的水就会被大气压入烧瓶,形成美丽的喷泉。NH溶于水生成NHHO,其溶液显碱性,使酚酞变红色。温馨提示:()可能造成喷泉实验不能形成喷泉的原因:①若用气密性差的装置,一般不能形成喷泉。盛气装置要预先进行气密性检验,只有气密性合格者才能使用。②烧瓶不干燥③NH未充满烧瓶④塞子未塞紧⑤由胶头滴管挤入烧瓶内的水太少等。()有些气体虽然在水中溶解度不大,但能与某种溶液反应,从而产生压强差而。
6、爆发的原理与上述装置图________原理相似。【解析】()图引发喷泉只需挤压胶头滴管,打开止水夹即可,图则需先打开止水夹,再用热毛巾捂圆底烧瓶,发现有气泡冒出后,移去热毛巾即可。()能在锥形瓶内反应产生气体,压强大于圆底烧瓶内压强方可,故应选NHHCO和盐酸。其他要么不反应,要么反应不生成气体或产生气体很少。()浓HSO溶于水放出大量的热,使瓶内酒精汽化也会产生喷泉。()图、是上部压强减小导致喷泉,图是下部压强增大导致喷泉,人造喷泉及火山爆发均与图原理相似。【答案】()NHCl+Ca(OH)=====△CaCl+NH↑+HO①挤压胶头滴管,打开止水夹NH溶于少量水中,使圆底烧瓶内压强减小,烧杯内水喷入圆底烧瓶②打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾()D()A()减小增大氨水显弱碱性的主要原因是()A.通常状况下,氨的溶解度不大B.氨水中的NHHO电离出少量的OH-C.溶于。
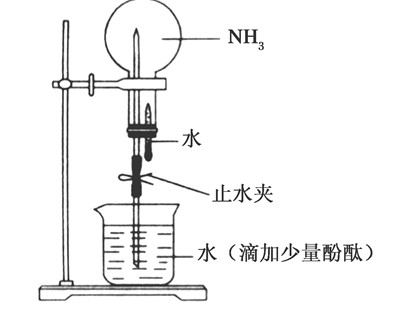
7、形成喷泉。实验反思:形成喷泉一定是形成内外压强差,只要具有了合适的压强差都会形成喷泉。.氨的化学性质()与水反应NH+HO===NHHO(一水合氨)NH+HONHHONH++OH-氨的水溶液叫氨水,氨气溶于水,大部分与水结合成一水合氨,常温下,一小部分一水合氨电离成NH+和OH-,所以氨水显弱碱性,能使湿润的红色石蕊试纸变蓝色。另外NHHO很不稳定,受热易分解:NHHO=====△NH↑+HO。特别提醒:①氨水中的微粒分析氨水中的有关反应便知氨水中含有:HO、NH、NHHO及NH+、OH-、H+。除水分子外,含量最多的为NHHO。②氨水的质量分数与密度大小之间的关系氨水的密度小于gmL-,所以NH的质量分数越大,溶液密度越小。这与硫酸恰好相反,硫酸的质量分数越大,密度越大。()与酸反应生成铵盐NH+HCl===NHCl(产生大量白烟),NH+HNO===NHNO(产生大量白烟),NH+HSO。
8、水的氨分子只有少量电离D.氨本身的碱性弱【解析】氨气溶于水后,大部分与水结合生成一水合氨(NHHO),NHHO仅有少部分电离成NH+和OH-,因此显弱碱性,氨水显弱碱性既不是因为氨的溶解度不大,也不是因为氨分子电离的少(在水溶液里氨分子是不电离的),更不是因为氨本身的碱性弱(氨不与水反应时无碱性),故正确答案为B。【答案】B铵盐的性质及氨气的制法●教材点拨.铵盐()定义:由铵根离子(NH+)和酸根离子构成的化合物叫做铵盐。()物理性质:都是晶体,都易溶于水。()化学性质①铵盐受热易分解NHCl=====△NH↑+HCl↑NHHCO=====△NH↑+CO↑+HO↑②铵盐和碱反应NHCl+Ca(OH)=====△CaCl+NH↑+HO(NH)SO+NaOH=====△NaSO+NH↑+HO()铵盐的检验化学原理:铵盐与碱反应生成氨气。检验方法:把NaOH溶液加到某物质的固体或溶液里,加热后产生无色有刺。
9、l+HO+NH↑.是否所有铵盐受热分解都会产生NH?是否所有的铵盐与碱反应均放出NH?提示:铵盐与碱反应放出NH,这是铵盐的通性。但一些铵盐受热分解情况复杂,如NHNO受热分解不产生NH。.收集氨气的试管口为什么要放一团棉花?提示:由于NH密度比空气小,容易与空气形成对流,试管口塞一团棉花可以减缓对流的作用收集更纯的NH,同时也避免污染空气。●自主探究新思维•名师讲堂.氮的固定()概念:将游离态的氮转变为化合态的氮的方法。()分类氨的性质及用途●教材点拨氮的固定自然界固氮高能固氮N+O=====放电NO生物固氮豆科植物的根瘤固氮人工固氮工业固氮工业合成氨N+H高温、高压催化剂NH仿生固氮金属有机化合物作催化剂.氨的物理性质()色、态、味:无色、有刺激性气味的气体。()溶解性:极易溶于水,在常温常压下,体积水约能溶解体积氨气。()易液化。
考点三 表格分析型实验题的正误判断 12.(2016·全国甲卷)下列实验操作能达到实验目的的是()选项 实验目的 实验操作 a 制备fe(oh)3胶体 将naoh浓溶液滴加到饱和fecl3溶液中 b 由mgcl2溶液制备无水mgcl2 将mgcl2溶液加热蒸干 c 除去cu粉中混有的cuo 加入稀硝酸溶解,过滤、洗涤、干燥 d 比较水与乙醇中氢的活泼性 分别将少量钠投入到盛有水和乙醇的烧杯中 解析:选da项中,制备fe(oh)3胶体,应把饱和fecl3溶液逐滴加入到沸水中,继续煮沸至溶液呈红褐色,反应为fecl3+3h2ofe(oh)3(胶体)+3hcl。(3)为到净化气体的目的应使气体通过溶液,所以气体应从a通入溶液,通过溶液装置d内盛放的碳酸氢钠溶液能与混在气体中的hcl发生反应生成氯化钠、水和二氧化碳,从而除去混在气体中的hcl,反应的化学方程式为:nahco3+hcl═nacl+h2o+co2↑。a.制氧气时,用na2o2或h2o2作反应物选择的气体发生装置相同b.制氯气时,用饱和nahco3溶液和浓硫酸净化和干燥气体c.制氢气时,用浓硫酸与锌反应比用稀硫酸快d.制二氧化氮时,用水或naoh溶液吸收尾气。
11、在降温或加压条件下,气态氨液化成无色液体,同时放出大量的热,液氨汽化时要吸收大量的热,使周围物质的温度急剧下降,因此常被用作制冷剂。()密度小:用向下排空气法收集。()喷泉实验①在干燥的圆底烧瓶里充满氨气,用带有玻璃管的塞子塞紧瓶口。②倒置烧瓶,使玻璃管插入盛有水的烧杯中。③轻轻挤压滴管,使少量的水进入烧瓶。④打开止水夹结论:NH极易溶于水,挤入滴管内的少许水,可以吸收烧瓶中的大量NH,烧瓶内气压迅速减小,打开止水夹,烧杯内的水就会被大气压入烧瓶,形成美丽的喷泉。NH溶于水生成NHHO,其溶液显碱性,使酚酞变红色。温馨提示:()可能造成喷泉实验不能形成喷泉的原因:①若用气密性差的装置,一般不能形成喷泉。盛气装置要预先进行气密性检验高中化学喷泉实验,只有气密性合格者才能使用。②烧瓶不干燥③NH未充满烧瓶④塞子未塞紧⑤由胶头滴管挤入烧瓶内的水太少等。()有些气体虽然在水中溶解度不大,但能与某种溶液反应高中化学喷泉实验,从而产生压强差而 。
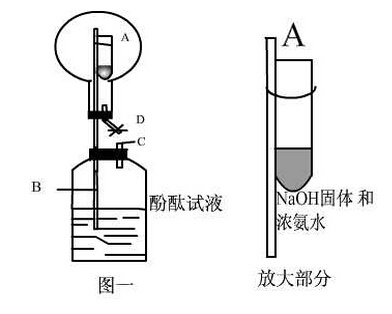
c.将浓氨水滴到生石灰上d.加热氯化铵固体()根据上述正确的方法,选用图所示的装置制取氨气,写出试管中所发生反应的化学方程式.一段时间后,将一端蘸有浓盐酸的玻璃棒接近。()实验室用氧化钙固体与浓氨水反应来制备氨气,反应的发生装置应选择适用于固体与液体在常温下反应制取气体的装置a。(4)通常状况下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,形成的溶液是氨水.实验室常用加热氯化铵和消石灰的固体混合物制取氨气,请完成下列问题:实验室制取氨气的发生装置应选择的发生装置是。
相似文档:
✔高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)(推荐阅读)
【资源下载】高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)地址
关于高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)资料下载
【精】高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)
【推荐】高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)(全屏阅读)
(✔)高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)_共59页
关于高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)查询结果
☑☑高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)_精品资料
◆◆高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)-资源下载
高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)-资源下载(手机版)
高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)(范文1)
高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)(模版2)
高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)(样例3)
高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)(资料4)

高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)(资料4)
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】
【高中化学第四章第4节第1课时氨的性质与制法课件新人教版必修159页(定稿)】