A.VA的某些单质及其化合物常用于制作太阳能电池.半导体材料
题目内容
5.A、VA的某些单质及其化合物常用于制作太阳能电池、半导体材料等.
w为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍,其外围电子排布式为:3d64s2,核外电子排布为:1s22s22p63s23p63d64s2,故w为fe元素,w为fe元素,e为26号元素,其核外电子总数为26,核外电子排布为:1s22s22p63s23p63d64s2,其基态原子的外围电子排布图为:。 吸收 发射 原子 光谱分析 举例说明光谱分析的应用: 科学家们通过太阳光谱的分析发现了稀有气体氦,化学研究中利用光谱分析检测一些物质的存在与含量等 高中化学:第一章第一节《原子结构》课件:ppt(人教版选修3) 第一章 物质结构与性质 第一节 原子结构 1、进一步认识原子核外电子的分层排布 2、知道原子核外电子的能层分布及其能量关系 3、知道原子核外电子的能级分布及其能量关系 4、能用符号表示原子核外的不同能级,初步知道量子数的涵义 5、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 6、能用电子排布式表示、简化电子排步式常见元素(1~36号)原子核外电子的排布 学习目标 背景知识回顾 1、。解析:(1)as元素在周期表中处于第a族,位于p元素的下一周期,则基态as原子核外有33个电子,根据核外电子排布规律写出其核外电子排布式:1s22s22p63s23p63d104s24p3 或[ar]3d104s24p3。
(2)硒、溴与砷同周期,三种元素的第一电离能从大到小顺序为Br>As>Se(用元素符号表示).
(3)气态SeO3分子的立体结构为平面三角形,与SeO3互为等电子体的一种离子为CO32-或NO3-(填化学式).
(4)硼元素具有缺电子性,因而其化合物往往具有加和性.
①硼酸(H3BO3)是一元算酸,写出硼酸在水溶液中的电离方程式H3BO3+H2O?[B(OH)4]-+H+.
h3bo3晶体是分子晶体,相互之间通过氢键相连,每个b原子形成三条b—o极性键,每个o原子形成一条o—h极性价键,共6条极性键。9.正硼酸(h3bo3)是一种片层状结构白色晶体,层内的h3bo3分子通过氢键相连(如下图)。3.在40 gpa高压下用激光器加热到1 800 k时成功地制得了原子晶体co2,下列有关推断正确的是 ()a.原子晶体co2易汽化,可用作制冷剂b.构成原子晶体co2中的微粒是co2分子c.原子晶体co2有很高的熔沸点,有很大的硬度d.每摩尔原子晶体co2中含碳氧键的数目为2na答案c解析该“co2”晶体为原子晶体,不再有单个的co2分子,具有很高的熔、沸点和硬度,每摩尔晶体中应含有4na个碳氧键。

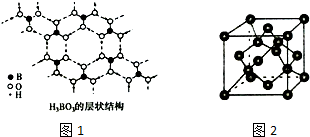
苏州)小明在实验室用天平和量筒测量矿石的密度,他先把托盘天平放在水平桌面上,将游码移到标尺左端的零刻度线处,发现指针在图甲位置静止,接着他将天平右端的平衡螺母向左调节,使横梁在水平位置平衡,然后他用天平测量矿石的质量,示数如图乙所示,则矿石的质量为52g.最后他用量筒测量矿石的体积,示数如图丙所示,由此可得矿石的密度为2.6×103kg/m3.。3. 在“用天平和量筒测定固体和液体的密度”实验中,为测定物体的质量,调节天平横梁平衡时,发现天平的指针静止在分度盘中央刻度线的左侧,则应将横梁上的平衡螺母向__________ 调节,将一矿石标本放在已调好的天平左盘内,当天平重新平衡时右盘内的砝码和游码在标尺上的位置如图8甲所示,则矿石的质量为__________克seo3等电子体,将矿石标本放入装有水的量筒中,量筒中水面位置的变化情况如图8乙所示,则矿石的体积为__________厘米3.这种矿石的密度为__________千克/米3.。(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是______,平均每个晶胞所占有的原子数目是__________。
分析 (1)砷是33号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
3.根据价层电子对互斥理论及原子的杂化理论判断nf3分子的空间构型和中心原子的杂化方式为()a.直线形sp杂化 b.三角形sp2杂化c.三角锥形sp2杂化 d.三角锥形sp3杂化解析:选d在nf3分子中,n原子上价层电子对数(5+1×3)=4价层电子对互斥模型为四面体,孤电子对数4-3=1,则nf3分子的空间构型为三角锥形。x 价电子排布式为 ns n np nseo3等电子体,元素 z 基态原子 s 电子总数与 p 电子总数相等,w 与其它四种元素能层数不同,且未成对电子数目为 1 个。根据杂化轨道数=价层电子对数=4,则由1个s轨道和3个p轨道参与杂化,为sp3杂化。
(4)①硼酸为一元弱酸,在水溶液里电离出阴阳离子;
②根据1个正硼酸分子能形成3个氢键,1个正硼酸分子能形成6个σ键,据此计算1molH3BO3的晶体中氢键物质的量;
根据图知,正硼酸(H3BO3)中每个B原子连接3个O原子且不含孤电子对,据此确定B原子杂化方式;
(5)单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与晶硅中Si的结构相似;利用均摊法计算晶胞中Si原子数目,进而计算晶胞质量,再根据V=$\frac{m}{ρ}$计算晶胞体积,计算晶胞棱长,进而计算晶胞体对角线.
【典型例题】a.电子的能量越低,运动区域离核越远b.当m层是最外层时,最多可排布18个电子c.稀有气体元素原子的最外层都排有8个电子d.核外电子的分层排布即是核外电子的分层运动【答案】d考点:核外电子排布【点评】高中化学必修部分对核外电子排布规律要求比较基础,掌握电子排布的基本规律和前20号元素原子的电子排布,能画出1~18号元素的原子结构示意图即可。【解答】解:a的周期数等于其主族序数,应为h元素,b原子的价电子排布为nsnnpn,n=2,应为c元素,d是地壳中含量最多的元素,应为o元素,则c为n元素,e是第四周期的p区元素且最外层只有2对成对电子,应为se元素,f元素的基态原子第四能层只有一个电子,其它能层均已充满电子,为cu元素,。考点:原子核外电子排布专题:原子组成与结构专题分析:对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断.解答:解:a、光气(cocl2)中c元素化合价为+4,c原子最外层电子数为4,所以4+4=8,c原子,满足8电子结构。
故答案为:1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3);
(2)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为:Br>As>Se;
故答案为:Br>As>Se;
下列判断错误的是()a.ph3分子呈三角锥形b.ph3和nh3分子中孤电子对数相同c.ph3分子中h原子之间是非极性键d.ph3分子稳定性低于nh3分子,因为n—h键键能高解析:选ca项,ph3分子结构和nh3相似,都是三角锥形结构,正确。3.根据价层电子对互斥理论及原子的杂化理论判断nf3分子的空间构型和中心原子的杂化方式为()a.直线形sp杂化 b.三角形sp2杂化c.三角锥形sp2杂化 d.三角锥形sp3杂化解析:选d在nf3分子中,n原子上价层电子对数(5+1×3)=4价层电子对互斥模型为四面体,孤电子对数4-3=1,则nf3分子的空间构型为三角锥形。n3h分子中,n原子形成3个σ键,且有1个孤电子对,n原子的轨道杂化类型为sp3,立体构型为三角锥形。
故答案为:平面三角形;CO32-或NO3-;
(4)①硼酸为一元弱酸,在水溶液里电离出阴阳离子,其电离方程式为:H3BO3+H2O?[B(OH)4]-+H+;

故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(3)在h2、(nh4)2so4、sic、co2、hf中,由极性键形成的非极性分子是________,由非极性键形成的非极性分子是________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________________,属于离子晶体的是________________,属于原子晶体的是________________,五种物质的熔点由高到低的顺序是________________。h3bo3晶体是分子晶体,相互之间通过氢键相连,每个b原子形成三个b-o极性键,每个o原子形成o-h共价键,共6个键。6.在乙烯分子中有5个σ键、1个π键,它们分别是()a.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键b.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键c.c—h之间是sp2形成的σ键,c—c之间是未参加杂化的2p轨道形成的π键d.c—c之间是sp2形成的σ键,c—h之间是未参加杂化的2p轨道形成的π键解析:选a乙烯分子中,每个c原子都采用sp2杂化方式,每个c原子上各有3个sp2杂化轨道和未杂化的2p轨道,其中3个sp2杂化轨道中,1个用于与另一个c原子形成c—c σ键,2个用于与2个h原子形成c—h σ键,未参与杂化的2p轨道“肩并肩”重叠形成c—c π键。
分析:如果化合物中元素的最外层电子数+化合价的绝对值=8,则该元素满足8电子稳定结构,否则不是.解答:解:a、水分子中,氢原子最外层有2个电子,所以氢原子不满足8电子稳定结构,故a错误.b、氨气分子中,氢原子最外层有2个电子,所以氢原子不满足8电子稳定结构,故b错误.c、氯气分子中,氯原子最外层有7个电子,两个原子共用1个电子对使两个原子都达到8电子稳定结构,故c正确.d、氯化硼中,硼原子最外层有6个电子,所以硼原子最外层不满足8电子稳定结构,故d错误.故选c.点评:本题考查了8电子稳定结构的判断,难度不大,注意根据“化合物中元素的最外层电子数+化合价的绝对值=8,则该元素满足8电子稳定结构,否则不是”判断即可.。3.根据价层电子对互斥理论及原子的杂化理论判断nf3分子的空间构型和中心原子的杂化方式为()a.直线形sp杂化 b.三角形sp2杂化c.三角锥形sp2杂化 d.三角锥形sp3杂化解析:选d在nf3分子中,n原子上价层电子对数(5+1×3)=4价层电子对互斥模型为四面体,孤电子对数4-3=1,则nf3分子的空间构型为三角锥形。要求掌握:原子的核式模型、玻尔理论及应用、电子自旋假设及相关实验、原子的精细结构、双电子原子、泡利不相容原理、角动量耦合、原子态的形成及原子基态的确定、x射线产生的机制及x射线的能级图和吸收限、原子核的基本性质、放射性衰变和核反应基本规律等。
故答案为:3;6;sp2;
(5)GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体;
该晶胞中Si个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,故晶胞质量为$\frac{8×28}{{N}_{A}}$g=$\frac{224}{{N}_{A}}$g,硅晶体的密度为ρg•cm-3,则晶胞棱长=$\root{3}{\frac{\frac{224}{{N}_{A}}}{ρ}}$cm,则晶胞体对角线长度为$\sqrt{3}$•$\root{3}{\frac{\frac{224}{{N}_{A}}}{ρ}}$cm,故最近的两个硅原子之间的距离为$\sqrt{3}$•$\root{3}{\frac{\frac{224}{{N}_{A}}}{ρ}}$cm×$\frac{1}{4}$=$\frac{\sqrt{3}}{4}$•$\root{3}{\frac{224}{ρ{N}_{A}}}$cm;
$$\begin{aligned}d(a,b) & = \sqrt{(x_b - x_a)^2 + (y_b-y_a)^2} \\d(a,b) & = \sqrt{(-1 - 3)^2 + (3 - (-4) )^2} \\d(a,b) & = \sqrt{(-4)^2 + (3 + 4 )^2} \\d(a,b) & = \sqrt{16 + 49} \\d(a,b) & = \sqrt{65} \\d(a,b) & \approx 8.062\end{aligned}$$。$$ w_{ij}=\frac{\sum_{l}n_{ijl}*\alpha ^{l}}{\sqrt{|n(i)||n(j)|}}(i 点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、分子结构与性质、晶胞计算等,需要学生具备一定的空间想象与数学计算能力,难度中等. 练习册系列答案 中考备战系列答案

品学双优系列答案
微课程单元自测系列答案
微课程学案导学系列答案
优化全练系列答案
智汇图书计算天天练系列答案
小学同步达标单元双测AB卷系列答案
基础精练系列答案
练习册河北大学出版社系列答案
探究学案全程导学与测评系列答案
新老板当然有些失落