甲烷及氯气取代反应实验改进_0

(2) 将氯气先经光照,,然后在黑暗中放置一段时间再与甲烷混合,则不发生氯代反应。热式气体质量流量计:可用于测量各种形状、材质管道(如圆管、方管、矩形管等,管径从8mm到50000mm或更大,各类金属、塑料、水泥等材质)中的空气、氮气、氧气、臭氧、氦气、氦气、氢气、甲烷、乙烷、丙烷、乙烯、丙烯、一氧化碳、二氧化碳、笑气、二氧化硫、硫化氢、氟化氢、磷化氢、氯气、氨气、氟利昂、异丁烷、正戊烷、甲烷、瓦斯、沼气、各类高炉焦炉煤气水煤气半水煤气混合煤气、天然气、含尘烟道气、化工混合气等各种单一或混合气体(除乙炔气)的标准状态体积流量或质量流量。通过甲烷与氯气光照下反应的实验,培养学生观察、分析、思考等能力。

b项,cl2能与nahco3反应,且hcl与nahco3溶液反应生成co2气体,使得cl2中又会混入杂质co2,应选用饱和nacl溶液,b项错误。(2)实验生成氯气,可用排饱和食盐水法测定生成氯气的体积,可确定次氯酸钙的含量,连接顺序为a接e,d接f,。已知20℃时某些物质的溶解度如下(气体指1atm时1体积水中能溶解的气体体积)物质naclnahco3nh4clnh3co2溶解度36.0g9.6g37.2g7100.9又知侯氏联合制碱法主要原理:nacl(饱和)+nh3+co2+h2o=nahco3↓+nh4cl(1)该反应能够成功进行的原因有①,②,③。
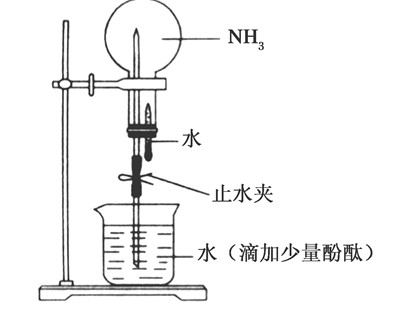
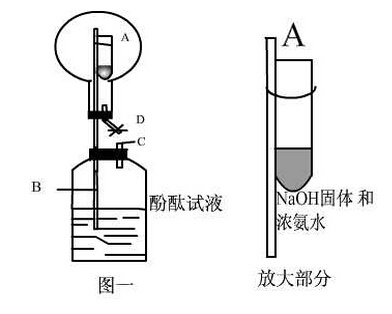
利用上述实验装置,笔者进行多次实验,虽能看到部分实验现象,但总觉得不尽理想。可见,上述三个实验装置都不能达到预期的效果,存在某些不足的地方。因此,希望通过改进实验,能得到理想的实验效果。笔者对该实验做了如下的改进。3 改进后的实验(1)实验材料:①用 100 mL 注射器作为反应器;②250 W的高压汞灯;③氯气与甲烷体积比为 3�1(75 mL 氯气, 25 mL甲烷), 实验装置如图 4 所示。实验操作过程:用 100 mL 注射器从储气袋中抽取氯气 75 mL,再在储气瓶中抽取甲烷 25 mL,把针头插进橡胶塞内密封好针头,然后,在注射器内塞与外筒交界处涂上少量的机油,旋转内塞,使机油均匀涂在注射器内塞与外筒交界处,这样既密封又润滑。接着,把注射器按图 4 所示装在铁架台上,用250 W 的高压汞灯照射,光源离注射器距离 15 cm 左右。如果室温较低,可缩短光源离注射器的距离,如 10 cm 左右。光照约半分钟左右,活塞开始上升,1 分钟左右,体积可上升至 140 mL 左右,随后缓慢回落到 100 mL,此时可看到注射器内气体黄绿色褪去,说明氯气已反应。注射器筒内壁有少量的无色油状液滴,说明有氯代甲烷生成。

冷却片刻,筒内气体体积仍4 然在 100 mL。反应后气体体积与反应前气体体积相同(或很接近)的原因,主要是有氯化氢气体,同时,生成的一氯甲烷常温下是气体,而二氯甲烷、三氯甲烷、四氯甲烷等在常温虽是液体,由于生成的量少,且它们易挥发,很大部分以气体形式存在,因此,反应气体体积改变不大。检验筒内气体,把针头靠近盛浓氨水的试剂瓶口,缓慢推动活塞可看到有浓烟产生,注入硝酸酸化的硝酸银溶液有白色沉淀产生。虽然用氯气进行上述实验也会出现相同的现象,但从颜色上可以区别氯气与氯化氢气体。去掉针头,将针筒插入滴有石蕊试液的水中,可形成红色喷泉(如图 5 所示),这一现象可有力证明该无色气体是氯化氢气体。喷泉实验后,发现注射器内尚有 15 毫升左右的无色气体。检验该气体:把针头插入澄清的石灰水,缓慢推动活塞,澄清石灰水未见浑浊现象,说明不是二氧化碳;把针头靠近酒精灯火焰,缓慢推动活塞,未见燃烧现象,说明不是未反应的甲烷;也没有看到酒精火焰明显变亮,说明气体不助燃,也不是氧气高中化学喷泉实验。这主要是在制取甲烷和氯气气体时,不可能得到很纯的气体,有空气混杂在其中,最后剩余的可能是氮气等。可见,改进后的实验,上述四个指标性现象都能很好地实现。
问题是蓝绿藻制造的氧气很容易与甲烷气体发生反应,导致大气中甲烷量的减少。有时试管内的液体反应很剧烈,会产生大量气泡,是液体体积膨胀(类似于沸腾)此时往往伴随着大量的热放出(有的还有腐蚀性),会伤害实验操作者,用三分之一,是给一般反应留出反应空间,对于反应后体积放大倍数很大的实验,会有特殊装置来确保实验安全.。实验1中mno2的作用是催化剂,实验2中又加入硫酸,生成气体体积增大,且为实验1中的2倍,说明二氧化锰不是催化剂,实验1中过氧化氢分解时发生反应:2h2o2 2h2o+o2↑,可知实验2中过氧化氢中氧元素全部被氧化为氧气,二氧化锰起氧化剂作用,反应离子方程式为:h2o2+2h++mno2=mn2++2h2o+o2↑,。
附:乙烷制取及乙烷与氯气的取代反应 6 1. 乙烷的制取,(1)实验仪器:硬质玻璃管,碾钵,酒精灯,铁架台,导管,储气瓶(2)药品:丙酸钠,氢氧化钠,氧化钙(3)反应方程式: CH3CH2COONa+NaOH→Na2CO3+C2H6根据方程式可知,丙酸钠与的氢氧化钠恰好完全反应的质量比为 96�40。笔者按这个质量比例进行实验,用 24 克丙酸钠、10 克氢氧化钠、10 克氧化钙。先称取氢氧化钠 10 克,氧化钙 10 克,在碾钵中碾细拌匀。再称取丙酸钠 24 克与之混合拌匀,装入硬质玻璃管, 按图(6)搭好实验装置。 用酒精灯加热,加热时先移动酒精灯,使玻璃管受热均匀,然后定点加热。经过多次反复实验,结果不尽理想,产生气体速度慢,量也少。通过调整丙酸钠、氢氧化钠 、氧化钙这三中物质的质量比例,终于得到一个比较理想的结果。在调整这三中物质的质量比例关系时,基于以下几方面的考虑:(1)这是固体与固体之间的反应,反应物之间的接触没有液体之间接触充分;同时丙酸钠脱羧较难,应适当增加氢氧化钠的量,丙酸钠与氢氧化钠质量比采用 5�3。(2)为了增加反应混合物的吸水性,应提高氧化钙的质量比,氧化钙与氢氧化钠的质量比采用 4�3。
按这样的质量7 比例投入实验,在多次的实验中,结果比较理想,放出的气体速度快,量也多。在本实验中,先称取氢氧化钠 15 克 , 氧化钙 20 克,在碾钵中碾细拌匀,再称取丙酸钠 25 克与之混合拌匀,装入硬质玻璃管,所用的实验装置如图 6。把制得的乙烷气体储藏在储气瓶中备用。(2)乙烷与氯气取代反应使乙烷全部被氯气取代,氯气与乙烷的体积比应为 6�1,但按这样的体积比来取料(即用 85 mL 氯气与 15 mL 乙烷),反应速度慢,最后氯气的黄绿色也没有完全褪尽,其主要原因是乙烷的量少,在光照条件下产生的乙烷自由基浓度低,影响反应速度。再者,当有一氯乙烷、二氯乙烷生成时易凝结成液体,这样会影响氯气与氯烷自由基的进一步取代,造成氯气不能完全反应,最后氯气的黄绿色不能完全褪尽。经过多次的实验,不断调整氯气与乙烷的体积比例,氯气与乙烷的体积按 3�2 的比例(即在 100 mL 的针筒中吸入 60 mL的氯气和 40 mL 的乙烷气体),反应现象最理想。反应速度也快。实验装置如图 4。当光照一分钟左右活塞开始上升,立即升至 140 mL 左右,活塞马上开始回落至 100 mL,等待片刻,冷却后,针筒内混合气体体积减为 95 mL 左右。
c. ba2+ d. ag+ 20. 60mlco2和 o2的混合气体通过足量的过氧化钠后, 所得气体恰好能与相同状况下的 80ml氢气完全反应, 则原混合气体中 co2和 o2的体积之比为( )a. 1: 1 b. 1: 5 c. 5: 1 d. 2: 1 21. 化学反应中的能量变化通常表现为________的变化, 氯气与铜的反应是_______热反应,ba(oh)2·。氯气是一种黄绿色有刺激性气味的气体,能溶于水,常温下1体积水能溶解2体积氯气。将自来水煮开就可以了,因为自来水有cl是因为用来消毒水的是氯气(cl),水中的氯加热会分解成气态,从水里跑出来.所以将自来水加热就可以除去cl 氯气(cl2)是一种黄绿色有刺激性气味的气体,能溶于水,常温下1体积水能溶解2体积氯气.在相同条件下,氯气比同体积的空气重,标准状况下,它的密度 3.214g/l.氯气容易液化。
或者让男的变太监