(6)亚硝酸钴钠溶液可以按以下方法配制.取23g亚硝酸钠.溶

实验探究二 so42- zn2+ e- e- so42- cu2+ k+ 盐桥工作示意图 cu zn k+ cl- k+ cl- k+ cl- k+ cl- k+ cl- cl- k+ k+ cl- k+ k+ k+ cl- cl- k+ cl- cl- cl- 1、勾通内电路 2.平衡电 荷,使溶液呈电中性 锌半电池 铜半电池 电极反应: 负极: 正极: 总反应: cu2++2e- cu zn-2e- zn2+ zn + cu2+ zn2+ + cu 锌铜原电池(盐桥) znso4溶液 cu zn cuso4溶液 盐桥 问题解决 二.加入盐桥后由两个半电池组成的原电池工作原理: 还原性强的材料作负极,失电子被氧化 电解质溶液中氧化性强的离子在正极得电子被还原 电子由负极经导线流向正极 两极之间通过盐桥构成闭合回路。途径Ⅲ:b与乙醇发生酯化反应生成d为,再发生还原反应得到目标物.解答:解:甲苯发生硝化反应生成a,途径i:a中氨基被还原生成对甲基苯胺,则a为,反应③为-nh2中h原子被-coch3取代,反应④为氧化反应,最后发生水解反应又得到氨基,再发生酯化反应得到目标物,由于氨基易被氧化,故步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化。发明是这样实现的一种彩色负片和彩色相纸通用的显定冲洗液和冲洗工艺,包括显影液a液和漂定液b液,将彩色显影剂与化学试剂配成显影液,彩色显影液使卤化银还原生成金属银影,并通过还原过程中所形成的彩色显影剂的氧化产物,与感蓝,绿,红三层感光层中的成色剂发生反应,分别形成黄,品红,青三层染料,通过黄,品红,青三层染料的迭合,形成彩色影像,彩显过程中所生成的金属银影用漂定液进行氧化,将金属银影从乳剂层中除去,通过cd-4显影剂及其它物质,使其即能冲洗彩色负片,又能冲洗彩色相纸,在cd-4彩色显影剂中,加入亚硫酸钠,四硼酸钠及微量硫代硫酸铵,使底层青,品层的感光度上升,顶端黄层的感光度相对缓慢,并使负片和相纸三层色彩平衡。
(分)某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充: 、
。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。注意:NH4+也能与Na3Co(NO2)6生成黄色沉淀,会干扰K+离子的检验。请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
。
查看习题详情和答案>>
在仪器、药品、材料摆放之前,首先实验员把配置好的溶液在任课教师上课前先做一遍,同时还要检验仪器是否配套,药品是否变质,溶液浓度是否得当,实验效果是否明显等,如发现问题,及时解决,让教师上课的时候把演示实验的最佳实验效果演示给学生,保证实验的正常的开出。(3)①依据实验步骤可知步骤d是验证cu+可与浓氨水反应生成cu(nh3)2+(无色),该无色物质在空气中易被氧化变为蓝色,所以步骤c是验证白色沉淀可能是cucl,检验反应后的溶液中是否含氯离子,步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液,观察是否生成白色沉淀判断氯离子的存在,。 表5.2.2 混凝土强度的非统计法合格评定系数 原标准中非统计方法评定 原标准与新标准(标准差已知)评定方案对比 原标准与新标准(标准差未知)评定方案对比 原标准与新标准(非统计方法)评定方案对比 新标准混凝土强度的检验评定综述 合格评定方法:标准差已知方案(统计方法一) 标准差未知方案(统计方法二)(最常用) 非统计方法方案 合格评定条件:平均值 m。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充:
___________________________、______________________________。
方案二:亚硝酸钴钠法
coco3==coo+co2 (2)氢氧化钴 通常可在氯化钴溶液或硫酸钴溶液中用氢氧化钠溶液...再用化学沉淀和萃取等方法进一步使钴富集和提纯,最后得到钴化合物或金属钴...。【分析】x能和hcl反应生成气体甲,隔绝空气加热x得到气体甲和固体1,且x和hcl(aq)反应也能得到甲,因此猜测x是碳酸盐,因为x加热易分解且能和酸反应生成co2,那么甲为co2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐。【专利摘要】本发明提供了一种氯化钴溶液的制备方法,包括以下步骤:将电解钴、混合酸与水在第1级反应容器中进行反应,向上述第1级反应容器中加入混合酸,使第1级反应容器中的溶液溢流到第2级反应容器中,与第2级反应容器中的电解钴和水进行反应,向上述第1级反应容器中继续加入混合酸,使第2级反应容器中的溶液溢流到第3级反应容器,如此反复,直到第5级反应容器中的溶液溢流到第6级反应容器中,与第6级反应容器中的水混合,再经过萃取得到氯化钴溶液。
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+亚硝酸钠溶液配制。

查看习题详情和答案>>
某未知溶液X中可能含有K+、Fe2+、 、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+,对上述实验过程中的错误和疏漏之处加以纠正、补充:__________________________。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠〔Na3Co(NO2)6〕反应生成黄色沉淀〔K2NaCo(NO2)6〕,该原理可用于K+的检验。〔注意: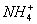 能与Na3Co(NO2)6生成黄色沉淀,会干扰K+的检验〕
能与Na3Co(NO2)6生成黄色沉淀,会干扰K+的检验〕
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+亚硝酸钠溶液配制。
查看习题详情和答案>>

某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充:
、。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。注意:NH4+也能与Na3Co(NO2)6生成黄色沉淀,会干扰K+离子的检验。
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
查看习题详情和答案>>

某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
若b在下层,则b为水:各取少量加水若互溶则为水,再加入氯化钙溶液,缓缓加入未知液b,和水混合后分层,用试管取出上层清液,不用任何试剂检验水和四氯化碳的方法是:取少量未知液a,碳酸钠过量时,若不互溶则为四氯化碳,缓缓加入未知液b(1)四氯化碳是一种难溶于水的有机溶剂。c、测定ph,玻璃棒蘸取待测液,滴在ph试纸上,ph试纸置于表面皿内,操作合理,故c正确。c.用已知浓度naoh溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,测得盐酸浓度偏小 d.用洗净铂丝蘸取未知溶液进行焰色反应,呈现黄色火焰,则该溶液有na+,但不能确定k+。
、。
方案二:亚硝酸钴钠法
在硝酸中不溶解4. 2氯化钻含量的测定4.2 1 方法提要 在酸性介质中, 试验溶液中的钻和硫氰酸根生成硫氰酸钻[co(scn), ]'一 离子式的络合物, 在丙酮存在下, 用乙二胺四乙酸二钠(edt a)标准滴定溶液与钻生成络合物, 到达终点时, 蓝色消失。3、下列离子的溶液与na2s溶液反应,生成黄色沉淀的一组是( )。(14)i-: ①加agno3溶液有黄色沉淀生成,加稀hno3沉淀不溶解:ag++i-=agi↓。
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
查看习题详情和答案>>
打压得够狠