高考化学高频考点分析
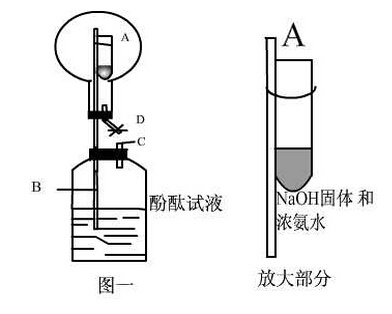
今天调研君为大家总结高考化学高频考点,从选择题——推断题——实验题——计算题。高中化学喷泉实验
不同的题目所要求掌握的知识程度也不一样,大家一定要注意,在有限的时间里掌握重点,掌握高频点!
对于高中化学而言,高频考点主要包括:
高频考点一:选择题
选择题主要考查内容包括:
离子能否大量共存、元素化合物(碱金属、Al、Zn、Mg、Fe、Cl、S、P、N的单质及其化合物的化学式、性质、用途、离子鉴别等)、阿伏加德罗常数、阿伏加德罗定律及其推论、物质的量的计算、元素的“位-构-性”关系、同位素的原子结构;
常见分子的空间结构、晶体的类型与性质、外界条件对化学反应速率及平衡移动的影响、原电池原理、电解原理、官能团的结构及性质、同分异构体、同系物;

氧化还原反应、热化学方程式的书写及正误判断、盐类水解、pH的简单计算及与溶液酸碱性的关系、弱电解质的电离平衡及移动、多步反应关系式的确定、实验方案设计及评价。
高频考点二:推断题
推断题包括无机推断和有机推断。
初中推断题中有一种文字叙述式的物质推断题,作为这类推断题的解题突破口即题眼的往往是物质的一些特殊颜色或特征反应及其现象的有关知识。 无机胶黏剂主要是以木质素为原料加以开发成为新型的无机胶黏剂材料无机胶黏剂按固化方式的不同可分为熔融固化型、挥发固化型、遇水固化型、反应固化型,其中反应固化型应用最广,硅酸盐无机胶黏剂就属于此类。污泥减量微生物制剂 污泥减量微生物制剂提供商 吸附去除结果:有机物从污水中转移到活性污泥上去 2. 微生物代谢 酶:透膜酶 大分子(水解酶)→小分子(透膜酶)→细菌体内→微生物代谢 ↗(分解代谢)→无机物+q ↗残存物质(20%) 有机物+o2(异养菌)→(合成代谢)→新细胞(内源代谢)→无机 物质+q(80%)4.2 活性污泥净化反应影响因素与主要设计运行参数 一. 影响因素 1. 营养物质平衡:。
推断题:物质结构(核外电子排布、晶体性质)、典型物质的化学性质等;方程式的书写:审题(离子方程式或化学方程式)、充分利用信息写出并配平(先氧化还原,再电荷守恒,后质量守恒)。
有机部分包括反应类型:加成,取代(硝化、酯化、磺化、水解),氧化(加氧、去氢),还原(加氢、去氧),消去(醇、卤代烃)、加聚,缩聚等(从结构改变判断);
化学式书写:注意题目要求(结构式、结构简式,化学式);化学方程式书写:生成有机物时别漏无机物,注意配平;有机合成:信息的使用;框图分析、官能团的改变特别要注意等。

高频考点三:实验题
实验考查在试题中的比重越来越大,搞好实验复习对提高分数有着至关重要的作用。高中化学喷泉实验
(二)药品试剂陈列整齐,放置有序、避光、防潮、通风干燥,瓶签完整,剧毒药品加锁存放、易燃、挥发、腐蚀品种单独贮存。⑸漂白粉 四、仪器 1. 研钵 2. 250ml 碘量瓶 称量瓶 量筒,20ml 10ml 5ml 3. 150ml 烧杯 容量瓶 250ml 具塞的磨口锥形瓶 4. 分析天平 0.0001g 台秤 0.1g5. 酸式滴定管,棕色 试剂瓶,棕色 6. 滤纸 7. 移液管 25ml 八、实验步骤 8.1 试剂溶液的制备 ①na2s2o3 溶液的配制及标定。如果当年没有启动苹乳发酵,可满瓶密封存放,酒液在过冬低温会析出酒酸石(米粒大小,晶体状),降低酒液的酸度,等来年温度合适时,用虹吸法除去沉淀,期待苹乳发酵会自然启动。
实验操作的注意事项:醛的2个典型反应(反应环境问题)、酯化反应(饱和Na2CO3溶液的作用)、苯酚与浓溴水(沉淀存在)、实验室制乙烯的温度、Fe(OH)2的生成操作(滴管在液面下)、几种仪器的读数(天平、量筒、滴定管等)、气密性检查:①常用方法、②特殊方法;喷泉实验原理;
尾气吸收的方法(导管、倒置漏斗、球形干燥管、燃烧);气体制备;装置连接顺序:(制备-除杂-干燥-验纯-检验-收集-性质实验-尾气处理);接口处理(强氧化剂存在时橡胶管的处理);
首先,鉴于定性微型实验已得到广大化学工作者的充分肯定,而在定量微型实验中,由于药品用量少,仪器小,有可能导致实验相对误差偏大或产率偏低,因此,学生实验主要限定于定性实验。(3)设汁装置、步骤根据实验目的和原理,以及所选用的仪器和药品,设计出合理的实验装置和实验操作步骤。然后分析数据并推理出结论定量实验设汁要精密一些,要尽可能避免一些误差初中常见的定量实验有:分子组成测定、混合物成分含量的测定、物质溶解度的测定、气体体积的测定等。
实验步骤:排序(气密性检查在装药品前)、操作书写(定量实验注意平行实验二次以上);

失败原因分析:漏气、条件控制不好、气体通入速度过快、冷却时吸水、干扰等;物质的检验、分离和提纯:物理方法、化学方法分离和提纯物质,物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理;
化学实验方案设计与评价:
(1)制备实验方案的设计思路
(2)性质实验方案的设计思路
(3)物质检验实验方案的设计思路:
①对试样进行外观观察,确定其颜色、气味、状态等;
②准备试样进行检验,当试样是固体时应先取少量配成溶液,同时观察试样是否溶解,在溶解时有无气体产生等,以初步判断试样可能含有哪类物质;

③根据实验现象得出结论。实验设计方案的评价从, 1.科学性(即实验原理、操作程序和方法必须正确);2.安全性(即用药及操作要注意安全、防暴沸、防倒吸、防污染等问题);3.可行性(要满足中学现有的实验条件);4.简约性(装置简单、步骤少、药品用量少、时间短)这几方面考虑。
高频考点四:计算题
7、溶质的质量分数与溶液体积、密度有关的计算计算依据: 溶液质量(m)=溶液体积(v)×溶液密度(ρ) 8、分离可溶物与不溶物时,可用过滤的方法。分析:利用有理数的混合运算法则,先算乘方,再算乘除,最后算加减,有括号应先算括号里面的,按照运算顺序计算即可判断出结果.。 sngi::气 姚 32c2 c3其中,a a,,a2,a3 ,b bb2,b, .c cc2,cj对升十算目价 己知氨基酸的手性,刻门可以通过计算由上面所给出的 3.1 式而得到的vecg,vec$v+w这三个向量的混合积来确定,而由上面混合积的定义中,翻门可以看至叶算混合积实际上就是求一个由hca4vmtivecy3这三个向量所组成蝴j列式的数值。
关系式法:题目给出多个有关的反应找出其关系列出比例式;
讨论法:题目要求某些范围;极限法,注意判断是关键;
化学平衡:等效平衡原理的应用;计算技巧:质量守恒、电荷守恒、电子守恒、“差量法”、“极端假设法”、“数形结合法”等。
提醒:
做题就做题,不准偷看答案!
期待ing