制取氨气并完成喷泉实验.(1)写出实验室制取氨气的化学方程式
题目内容
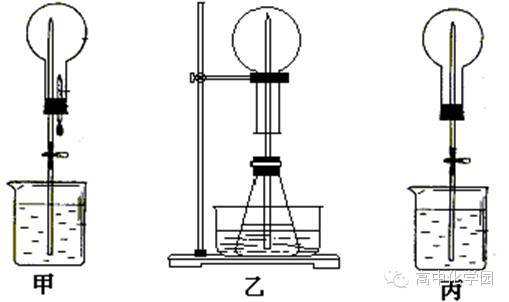
9.制取氨气并完成喷泉实验(图中夹持装置均已略去).

(1)仪器①的名称是长颈漏斗.如果该实验选择图(一)装置来制取氧气,则所用药品为h2o2、mno2(填化学式),反应的化学方程式为2h2o2$\frac{\underline{\。(3)小李在实验室中用氯酸钾和另一种固体制取氧气,他选择上述装置中的a和或(填字母)进行组装.小红在实验室中选用c装置作为氧气的发生装置.在他们的实验中都用到了一种相同的固体药品是(填化学式),请你写出小红制取氧气的化学反应方程式:.。实验制取氧气装置固不加的发生装,所以所用试剂该过氧溶液和二氧化锰,反应的方程式为:2h2o2。
(2)收集氨气应使用向下排空气法,要得到干燥的氨气可选用碱石灰作干燥剂.
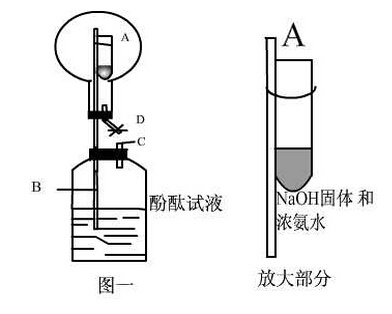
(3)用图Ⅰ所示装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发喷泉的操作是打开止水夹,挤出胶头滴管中的水,该实验的原理是氨气极易溶解于水,致使烧瓶内气体压强迅速减小.
如图 5所示,该散热模型自上而下由喷嘴、热沉、芯片和绝热材料构成,计算区域为10×10×10cm3,网格数为161728.文献[]中分别对3种不同的热沉在3种不同的雷诺数re下的散热情况进行了实验研究,这里选择2号热沉在re=6320时的实验工况作为验证对象,2号热沉的尺寸参数见表 1.其计算结果如图 6所示,其中ψ=h/d.。(5)如图乙所示为自动调温电熨斗的电路图.右下方为温控部分,a为双金属片,由两层不同金属粘合而成,受热时二者膨胀的快慢不同.在未通电和低于预定温度时,双金属片a和静片b上的触点接通,指示灯l亮,电热丝r发热,当温度达到预定温度时,由于双金属片的金属层(填“a”或“b”)膨胀较快,向左弯曲,电路断开,如图丙所示.调节调温旋钮c,使静片向左时,调温电熨斗的预定温度值将变______(选填“高”、“低”).。在热膨胀值程序内选择如图6中所示程序,并输入0.25mm膨胀偏差值,按确认键操作完成后,最后测量显示结果如图7所示。
气一固相接触催化氧化法的主要缺点是:① 由于反应温度较高,就要求反应原料和氧化产物在反应条件下具有足够的热稳定性,而且要求目的产物对进一步氧化有足够的化学稳定性。【分析】①工业用氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸。比粒经效应二 双功能和溢流催化作用第三节 绝缘体氧化物的金属载体相互作用一 简单绝绝体的相互作用二 沸石上的相互作用第四节 过渡金属氧化物的金属-载体相互作用:化学吸附研究得到的证据一 h2和co的化学吸附二 氧气的吸附和氢氧滴定三 氮气吸附第五节 过渡金属氧化物负载催化剂的结构信息一 x射线测量二 透射电子显微镜第六节 smsi对催化性质的影响。
分析 (1)验室用熟石灰和氯化铵在加热条件下反应制备氨气;
(2)氨气易溶于水,密度比空气小,溶液具有碱性,易与酸反应;
(3)利用氨气极易溶于水,形成压强差而形成喷泉,
(4)加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时会导致烧瓶内压强减小;
(5)氨气催化氧化生成NO和水.
解答 解:(1)实验室用熟石灰和氯化铵在加热条件下反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
(4)继续探究:①猜想二:根据题目信息可知,漂白粉的主要成分是ca(clo)2、cacl2和ca(oh)2,ca(clo)2+h2o+co2=caco3↓+2hclo,我们可以判断成分可能是:cacl2和ca(oh)2和caco3.故答案为:cacl2和caco3和ca(oh)2.。21、反应ca s +cl2 g →cacl2 s 能够自发进行,对△rh cacl2,s 贡献较大的是【21】(d)。根据题目信息可知,漂白粉的主要成分是ca(clo)2、cacl2,ca(clo)2+h2o+co2=caco3↓+2hclo,其部分变质,所以一定有生成的碳酸钙,还有未反应的cacl2,和部分未反应的ca(clo)2。
(2)氨气极易溶于水,不能用排水法收集,密度比空气小,用向下排空气法收集,氨气为碱性气体,用碱石灰干燥,
故答案为:向下排空气;碱石灰;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水;氨气极易溶解于水,致使烧瓶内气体压强迅速减小;

(4)加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时,因氨气极易溶于水而导致烧瓶内压强迅速减小而形成喷泉,
故答案为:打开夹子,用热毛巾将烧瓶捂热,氨气受热膨胀,赶出玻璃管内的空气,氨气与水接触,即形成喷泉;
(5)氨气催化氧化生成NO和水,反应的方程式为4NH4Cl+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH4Cl+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
【点评】本题考查物质的性质,综合考查元素化合物知识,把握物质的性质、性质与用途的关系为解答的关键,为高频考点,注意对相关知识的积累,题目难度不大.。【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、酯性质的考查,题目难度不大.。点评:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质题中的转换关系推导剩余的物质,最后进行验证即可。
获取整本练习册答案,下载作业精灵立即下载
练习册系列答案
名师导练系列答案
名师讲堂单元同步学练测系列答案
名师名卷单元月考期中期末系列答案
初中总复习教学指南系列答案
初中总复习全程导航系列答案
中考分类必备全国中考真题分类汇编系列答案
中考分类集训系列答案
中考复习导学案系列答案
中考复习信息快递系列答案
中考复习指导基础训练稳夺高分系列答案
相关题目
19.已知乙炔(C2H2),苯(C6H6),乙醛(C2H4O)的混合气体中氧的质量分数为8%,则混合气中氢的质量分数为()
18.高铁酸钾是一种高效多功能水处理剂.工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO+2Fe(NO3)3+10NaOH═2Na2FeO4↓+3NaCl+6NaNO3+5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH═K2FeO4+2NaOH
主要的生产流程如下:

(1)写出反应①的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4)(填“>”或“<”或“=”).
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.

①工业生产中最佳温度为26℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为6:5.
②若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O
6.分离、提纯物质的常用操作如下a溶解过滤 b蒸馏 c蒸发结晶d冷却热饱和溶液 (1)从盐水中分离出实验采用(填序号,下同) (2)从酒精溶液中分离出较纯的酒精,采用。本发明是基于该令人惊奇的发现,即用含氨溶液对含钼有机相、液体 或固体离子交换剂进行反萃取或解吸,可以得到nh3:mo比为0.9-1.4且钼 浓度为18-24%的反萃取或解吸溶液,可通过冷结晶直接从该溶液结晶出 ahm,而无需额外的耗能的中间步骤。制备过程中活性组分、助剂组分含量载体同【实施例1】,只是改变载体和沉淀剂的加料顺序,即将将i升含0.5摩尔/升硝酸铜、0.05摩尔/升硝酸镍和0.05摩尔/升硝酸钡的溶液作为溶液i,作为溶液i,将3摩尔/升的碳酸氢氨作为沉淀剂加入到溶液i中,控制终点ph为6.5,得到浆料ii,搅拌下将80克二氧化硅加入到浆料ii,得到浆料iv,900c陈化4小时,然后料浆经过滤、洗涤,得到的滤饼80~120°c烘干10小时,再在400°c焙烧5小时,焙烧后的催化剂压片成型即为催化剂。
A.H2OB.CH3COONa、异丙醇C.NH4Cl、异丙醇D.Fe(NO3)3、异丙醇.
19.某同学用下列装置制备干燥的Cl2并回收利用部分的物质.

(1)写出①中仪器X的名称圆底烧瓶.
(2)正确的楼法是a→e→d→c→b→f→g→h.
(3)若烧瓶中的MnO2需要回收利用,则应采取过滤分离方式.
(4)现将②中已知浓度与体积的浓硫酸用容量瓶配制成一定浓度的稀硫酸溶液,下列说法中正确的是AC
A.在配制之前,需要先对容量瓶进行检漏
B.把浓硫酸于烧杯中进行稀释后,马上转移到容量瓶中
C.若俯视刻度线进行定容,则所得的浓度会比实际浓度偏高
D.对所配制的溶液进行摇匀后,发现液面低于刻度线,则继续用胶头滴管加水至刻度线
E.在配制过程中,若使用的容量瓶里有水,则所配制的浓度会比实际浓度低.
17.下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.其中J为0族元素.
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为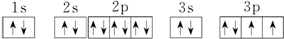 .
.
(2)在化合物YZ2中Y的化合价为+2;Y2-与Na+的半径大小为O2->Na+.
鲍林的原子轨道能级图是针对多电子原子体系的原子轨道近似能级顺序,它形象的说明了多电子原子体系中原子轨道能量的高低以及能级组的划分,指明了多电子原子体系中电子的填充顺序。解:原子序数电子排布式各层电子数周期族区金属或非金属810171929331s22s22p41s22s22p61s22s22p63s23p51s22s22p63s23p64s11s22s22p63s23p63d104s11s22s22p63s23p63d104s24p32、62、82、8、72、8、8、12、8、18、12、8、18、5二二三四四四via0viiaiaibvapppsdp非金属非金属非金属金属金属非金属例4.填空题:①哪种元素原子的原子半径最小()②哪种元素的第一电离能最大 ( )③原子中3p轨道半充满的元素是 ()④原子中3d、4s轨道都半充满的元素是 ()⑤元素电负性最小的元素是()⑥非金属性最强的元素是 ()分析:(1)原子半径、元素的电离能、电负性、金属性通过元素性质的周期性变化来确定(2)③、④按核外电子排布规律推断。2.主要是因为Ⅱa族元素原子最外电子层的s轨道处于全充满状态,p轨道处于全空状态,Ⅴa族的元素原子最外层3个能量相同的p轨道处于半充满状态,均属于相对稳定的状态,故这两个主族的元素原子相对难失去第1个电子,第一电离能相对较大,属于电离能周期性变化的特例。
4.设NA表示阿伏加德罗常数的值.下列说法正确的是()
12.0g熔融的NaHSO4中含有离子总数为0.2NA
电解精炼Cu时,导线中通过2NAe-时,阳极质量减少64g
标准状况下,11.2LCHCl3中含有的共用电子对数目为2NA
标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
[0002]氢,是一种21世纪最理想的能源之一,在燃烧相同重量的煤、汽油和氢气的情况下,氢气产生的能量最多,而且它燃烧的产物是水,没有灰渣和废气,不会污染环境。3.氢气作为燃料暂时还不能广泛使用的原因是:氢气的制取成本高和贮存困难.不过,目前对氢能源的开发已取得了很大进展,随着科技的发展,氢气终将会成为主要的能源之一.。氢能是未来最有希望的清洁能源之一,氢能的发展和利用不失为我国缓解能源压力的一种好的方式,氢气燃烧热值高,每千克氢燃烧后的热量,约为汽油的3倍,酒精的3.9倍,焦炭的4.5倍。
还是要打气