2017-2018学年高一化学(苏教版)必修1课件:专题4 第2单元 生产生活中的含氮化合物2
* * * * * * * * * * * * * * * * * 1.起固氮作用的化学反应是 A.N2与H2在一定条件下反应生成NH3 B.NO遇O2转化为NO2 C.硝酸工厂用NH3催化氧化制NO D.由NH3制碳酸氢铵和硫酸铵 解析由N2转化为氮的化合物叫氮的固定。 1 2 3 4 5 √ 答案 解析 解析NH3与HCl反应为非氧化还原反应,B项错误; 因NH3易溶于水,实验室制NH3用NH4Cl固体和熟石灰加热,C选项错误; 液氨汽化时,吸收大量热,可用液氨作制冷剂,D项错误。 2.有关氨气的实验较多,下面对这些实验原理的分析中,正确的是 A.氨气极易溶于水,可以用来做喷泉实验 B.氨气的还原性可以解释氨气与氯化氢的反应实验 C.NH3·H2O不稳定,实验室可用NH4Cl和石灰水制取氨气 D.NH3液化时放出大量的热,因而不能用氨作制冷剂 √ 1 2 3 4 5 答案 解析 3.下列离子方程式书写正确的是 A.实验室用氯化铵和熟石灰制氨:NH +OH-NH3↑+H2O B.NaOH浓溶液与NH4Cl溶液混合加热:NH +OH-NH3·H2O C.氨水中加盐酸:NH3·H2O+H+===NH +H2O D.氨水中加入氯化铁溶液:Fe3++3OH-===Fe(OH)3↓ √ 1 2 3 4 5 答案 解析 解析NH4Cl和Ca(OH)2固体加热,不是溶液中进行的反应,不存在离子浓度的变化,不属于离子反应,A项不正确; NaOH浓溶液和NH4Cl溶液混合加热放出NH3,不能写成NH3·H2O,B项不正确; 氨水与酸或盐反应,实质是NH3·H2O电离出的OH-参与反应,NH3·H2O为弱碱应写成分子形式,故C项正确,D项不正确。

1 2 3 4 5 4.以下有关氨及铵盐的叙述中不正确的是 A.铵态氮肥不能与碱性物质如草木灰混合施用 B.氨的喷泉实验体现了氨的溶解性和氧化性 C.实验室里常用固体氯化铵与氢氧化钙反应制取少量氨气 D.氨具有还原性,一定条件下可与氧化性的物质如氧气发生反应 解析氨的喷泉实验证明氨极易溶于水,不能体现氨的氧化性。 √ 1 2 3 4 5 答案 解析 5.实验室可用下列几组试剂制取少量NH3: ①固体Ca(OH)2和NH4Cl; ②浓氨水和固体CaO; ③浓氨水。 请回答下列问题: (1)用上述三组试剂制取少量NH3,需要加热的是________(填序号),第②组试剂中产生NH3的化学方程式可表示为_______________________________。 1 2 3 4 5 答案 解析 ①③ NH3·H2O+CaO ===Ca(OH)2+NH3↑ 解析①③需要加热,①组反应为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。 1 2 3 4 5 ②组反应为NH3·H2O+CaO===Ca(OH)2+NH3↑,由于CaO+H2O=== Ca(OH)2既消耗水,又放出热量,Ca(OH)2电离出OH-,增大了c(OH-),减少了NH3的溶解,因此不必加热,即放出NH3。

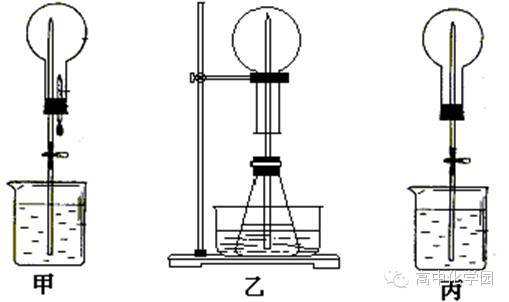
③组反应为NH3·H2ONH3↑+H2O。 (2)下面的制取装置图中,方法①应选用装置____(填“A”或“B”,下同),方法②应选用装置___。 1 2 3 4 5 答案 解析 A B 解析A装置适用于固体与固体加热制气体,B装置适用于液体与固体(或液体)不加热制气体。 (3)在制取后,如果要干燥氨气,应选用的干燥剂是______(填字母)。 A.浓硫酸B.固体氢氧化钠C.五氧化二磷 D.碱石灰E.固体CaOF.无水CaCl2 1 2 3 4 5 答案 解析 BDE 解析NH3只能用碱性干燥剂,可以用B、D、E干燥。 (4)检验集气瓶中是否收集满氨气的方法是___________________________ _______________________________________________。 1 2 3 4 5 答案 解析将湿润的红色石蕊试纸靠近集气瓶口,若试纸变蓝,说明NH3已集满(答案合理均可) 解析检验NH3一般用湿润的红色石蕊试纸。 1 2 3 4 5 答案 解析 (5)为防止环境污染,以下装置(盛放的液体为水)可用于吸收多余NH3的是_____(填序号)。

②④ 解析装置①没有出气导管,装置③易引起倒吸。 本课结束 * * * * * * * * * * * * * * * * * * * * 第2课时氮肥的生产和使用 专题4第二单元生产生活中的含氮化合物 学习目标定位 1.知道NH3的物理性质特点以及氨水显碱性的原因。 2.掌握氨气的实验室制取、收集和检验方法。 3.学会铵盐的性质及NH 的检验方法。 4.知道氮肥的性能和使用氮肥的注意事项。 内容索引 新知导学 —— 新知探究点点落实 达标检测 —— 当堂检测巩固反馈 新知导学 (1)按图所示装置,打开止水夹,挤压滴管的胶头,烧杯中的溶液由玻璃管进入烧瓶,形成,瓶内液体呈色。 (2)上述实验说明氨气溶于水,其水溶液呈性。 (3)反应的化学方程式是。 1.氨气易溶于水——喷泉实验 喷泉 红 一、氨气的性质 碱 易 NH3+H2ONH3·H2O 2.氨气与氯化氢的反应 (1)将分别蘸有浓氨水、浓盐酸的两支玻璃棒渐渐靠近,观察到的现象是。 (2)这是因为浓氨水挥发产生的氨气与浓盐酸挥发产生的氯化氢在空气中相遇迅速反应生成氯化铵晶体小颗粒。 (3)反应的化学方程式是。 有大量白烟产生 NH3+HCl===NH4Cl 3.从氮元素的化合价分析氨的性质 (1)NH3分子中氮元素的化合价为价,在化学反应中氮元素化合价可能的变化是,因此氨具有性。
(2)请写出氨气与氧气在催化剂作用下生成NO的化学方程式:_________。 -3 只能升高,不能降低 还原 4NH3+5O2 4NO+6H2O (1)氨气是一种无色有气味的气体、密度比空气,易液化。 ①氨气易溶于水,且与水反应生成弱碱。 ②氨气能与酸反应生成铵盐,其离子方程式是; ③氨气具有还原性,被催化氧化生成。 刺激性 小 归纳总结 NH3·H2O NH3+H+===NH NO (2)氨水的性质 ①氨水的电离方程式是NH3·H2O+OH-,具有性,能使红色石蕊试纸。 ②氨水不稳定,受热分解的化学方程式是 。 (3)氮的固定是将态的氮转变为态的氮的过程。主要有 ①雷电固氮:N2+O22NO。 ②生物固氮:豆科植物的根瘤菌吸收N2形成化合物。 ③人工固氮:N2+3H22NH3。 弱碱 变蓝 NH3·H2O NH3↑+H2O 游离 化合 1.下列关于氨水的叙述正确的是 A.氨水显碱性,是因为氨水是一种弱碱 B.氨水和液氨成分相同 C.氨水中物质的量浓度最大的粒子是NH3(除水外) D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、NH 物质的量之和为1 mol √ 答案 解析 活学活用 解析溶于水的氨气大部分与水反应生成NH3·H2O,所以,除水外,物质的量浓度最大的粒子是NH3·H2O;NH3·H2O是一种弱碱,在水中发生部分电离使溶液呈碱性;氨水中共含有六种粒子,分别是H2O、NH3、NH3·H2O、NH 、OH-和少量的H+,是一种混合物,液氨是纯净物,只有NH3分子。
2.如图所示的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是 A.CO2(浓NaOH溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉 C.SO2(浓NaOH溶液)/红色喷泉 D.HCl(AgNO3溶液)/白色喷泉 √ 答案 解析 思维启迪 解析气体与液体易发生反应或易溶即可形成喷泉。CO2→NaOH溶液反应,无色喷泉;NH3→H2O(含酚酞),易溶显红色,形成红色喷泉;SO2→NaOH溶液反应,无色喷泉;HCl→AgNO3溶液,反应生成白色沉淀,形成白色喷泉。 思维启迪 思维启迪 (1)喷泉实验能否成功,有三个关键因素:a.装置气密性良好;b.烧瓶必须干燥;c.气体必须充满。 (2)产生喷泉实验的原理:烧瓶内外产生压强差,当烧瓶内压强明显小于外界压强时就会产生喷泉实验。 (3)易产生喷泉的气体:a.易溶于水的气体与水的组合:NH3、HCl、SO2、NO2;b.酸性气体与碱液的组合:HCl、SO2、NO2、CO2、H2S等与NaOH溶液;c.碱性气体与酸液的组合:氨气与稀盐酸。 1.铵盐及其性质 (1)农业上常用的铵态氮肥,如等都属于铵盐,它们都是溶于水的晶体。
(6)实验室常用加热氢氧化钙固体和氯化铵固体混合物的方法来制取氨气,已知氨气的密度小于空气,易溶于水且能和水反应.则实验室制取氨气的发生装置为(填字母编号,下同),收集装置为.。6、氯化铵热象升华:意思是说在试管里加热氯化铵晶体,则氯化铵分解为氨和氯化氢气体,在管口冷却时又重新结合生成氯化铵固体,这个现象表面上象升华,但本质上不是升华。猜想3:该漂白粉全部变质,固体成分为____[实验探究]限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.实验操作实验现象实验结论①取少量样品于试管中,____有气体产生,气体使石灰水变浑浊.猜想2成立②在上述反应后的试管中加少量品红溶液.____....”主要考察你对“书写化学方程式、文字表达式、电离方程式”等考点的理解。
(2)氨气的发生装置与制取的装置相同。可用_________________来检验产生的氨气。用碱石灰(CaO和NaOH)干燥氨气,不能用、CaCl2(因为可生成CaCl2·8NH3)干燥氨气。 (3)实验室快速制取氨气的方法:用浓氨水和固体NaOH反应或直接加热浓氨水。 氯化铵或硫酸铵 Ca(OH)2 归纳总结 氧气 湿润的红色石蕊试纸 或浓盐酸 浓硫酸 3.下列说法中正确的是 A.所有铵盐受热均可以分解,产物均有NH3 B.所有铵盐都易溶于水,所有铵盐中的N均呈-3价 C.NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为NH +OH-NH3↑+H2O D.NH4Cl和NaCl的固体混合物可用升华法分离 √ 答案 解析 活学活用 解析A项,有的铵盐受热分解产生氨气(如NH4Cl),有的铵盐受热分解不产生氨气(如硝酸铵); D项,可用加热法分离NH4Cl和某些固体(不分解、不升华的固体)的混合物,但其过程为先受热分解,再降温化合,而不是升华。 A.①③ B.②③ C.①④ D.②④ 4.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 √ 答案 解析 解析实验室制取氨气的方法:铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应,固体与固体反应,因为有水生成,试管口应略向下倾斜,③错误; 在浓氨水中加入CaO,CaO与水反应使溶液中c(OH-)增大,消耗了水,并且放出大量的热,使NH3·H2O分解放出氨气,②正确; 加热浓氨水,加快氨气挥发,④正确; ①是错误的,因为氯化铵分解生成的NH3与HCl冷却后又生成NH4Cl,不能得到NH3。
1.氨和氨盐的性质 (1)氨的性质:氨气极易溶于水,能与水反应生成NH3·H2O,与酸反应生成铵盐,能催化氧化制备硝酸。 (2)铵盐的性质:铵盐易溶于水,加热易分解,能与碱反应生成氨气。 2.检验氨气的两种方法 (1)使湿润的红色石蕊试纸变蓝。 (2)用蘸有浓盐酸的玻璃棒靠近时会有白烟生成。 学习小结 达标检测 * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * * *
含亚硝酸盐