现代传感信息技术在化学实验中有广泛的应用.Ⅰ.某小组用传感技

现代传感信息技术在化学实验中有广泛的应用。
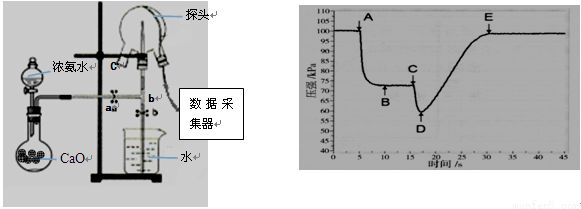
Ⅰ.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下nh3是一种无色、有刺激性气味的气体,密度比空气小.nh3极易溶于水,其水溶液呈碱性.。④实验室常用氯化铵固体与碱石灰固体共热来制取氨气(nh3),已知氨气极易溶于水,应选择的制取装置是.。(1)实验的原理(2)仪器的选择使用及原理(3)仪器的组装(顺序)方式方法(4)实验药品的选用(5)实验条件及其控制(6)实验现象及其解释(7)气体的除杂、干燥、净化、检验等实验(8)尾气处理与环境保护(9)安全事项(10)注意事项(11)实验室还可以用哪些药品、装置制取氨气(如在浓氨水中加入生石灰等方法)引导学生发散思维和创新。
检验三颈瓶集满NH3的方法是将靠近瓶口C处,若,则证明已收满。高中化学喷泉实验
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中点时喷泉最剧烈。
Ⅱ.室温下,测定NH3•H2O的浓度及电离平衡常数Kb
称取1.000g漂白粉于锥形瓶中,加水溶解,调节溶液的ph,以淀粉为指示剂,用0.1000mol•l-1ki溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3clo-+i-=3cl-+io3-io3-+5i-+3h2o=6oh-+3i2实验测得数据如下表所示.。取锥形瓶(250ml)一只,洗净后放在碱式滴定管下,以每分钟约10ml的速度放出约20mlnaoh溶液于锥形瓶中,加入一滴甲基橙指示剂,用hcl溶液滴定至溶液由黄色变橙色为止,读取并记录naoh溶液及hcl溶液的精确体积。(3)测定漂白粉有效成分的质量分数:称取1.000g漂白粉于锥形瓶中,加水溶解,调节溶液的ph,以淀粉为指示剂,用0.1000mol·l-1 ki溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。
ph=11的氨水浓度为0.1mol/l,所以氨水的电离程度为1%,有1%的含氮粒子为nh,c正确。l-1的氨水与b mol,将a mol,反应后溶液显中性.求25℃下该混合溶液中氨水的电离平衡常数b×10,则混合后溶液呈______,溶液呈______ (填“酸性”,溶液中铵根离子和氯离子浓度相等(1)将等体积等物质的量浓度的氨水和盐酸混合后。 计算公式:盐酸浓度×盐酸体积/氨水体积=氨水浓度 盐酸滴定法——gb/t631《化学试剂 氨水》 式中:v1—滴定消耗盐酸标准溶液体积,ml c1—盐酸标准溶液的浓度,mol/l v—氨水试样的取样体积,ml 0.01703---与盐酸标准溶液【c(hcl)=1.000mol/l】相当的以克表示的氨的质量。

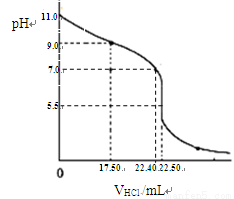
(5)关于该滴定实验的说法中,正确的是。
A.锥形瓶中有少量蒸馏水不影响测定结果
B.未滴加酸碱指示剂,实验结果不科学
C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D.滴定终点时俯视读数会导致测得氨水的浓度偏高
25℃时,水的电离达到平衡,H2O H++OH-;△H>0,下列叙述正确的是( )
H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变

C.向水中加入少量固体NaCl,平衡不移动,导电能力不变
D.将水加热,Kw增大,pH不变
下列有关离子浓度的比较正确的是
A.0.1mol•L-1氨水中,c(OH-)<c(NH4+)
D.0.1mol•L-1某二元弱酸碱性NaHA溶液中,c(H+)+c(H2A)═c(A2-)+c(OH-)
a.100 ml 0.1 mol/l bacl2的溶液中cl数为0.02 na b.22 g co2所含有的氧原子数为0.5 na c.11.2 l o2所含有的分子数为0.5 na。l-1的氨水与b mol,将a mol,反应后溶液显中性.求25℃下该混合溶液中氨水的电离平衡常数b×10,则混合后溶液呈______,溶液呈______ (填“酸性”,溶液中铵根离子和氯离子浓度相等(1)将等体积等物质的量浓度的氨水和盐酸混合后。取样品溶液2 ml,依次加入1.0 ml 0.01 mol/l feso4、1.5 ml 10% h2o2溶液,混匀静置10 min,再加入2ml 0.01 mol/l水杨酸溶液,混匀后37℃的恒温水浴锅中反应30 min,510 nm波长处测其吸光度。
(2)0.1 mol/kg 盐酸 和 0.1 mol/kg cacl2 溶液等体积混合后形成的溶液。 (3)10ml 0.2 mol·l-1 nh3·h2o 与10ml 0.1 mol·l-1 hcl的混合溶液。 (3)10ml 0.2 mol〃l-1 nh3〃h2o 与 10ml 0.1 mol〃l-1 hcl 的混合溶液。
h2o.设计实验测定co2和h2o的质量,方法是将燃烧后产生的气体先通过浓硫酸,后通过烧碱,称量装浓硫酸与装烧碱的集气瓶通过气体前后的质量变化而得,若原试样的质量等于co2中碳元素和h2o。孝感模拟)下列说法正确的是() a. 按系统命名法, 的名称为2,5,6﹣三甲基﹣4﹣乙基庚烷 b. 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 c. 肌醇 与葡萄糖的元素组成相同,化学式均为c6h12o6,满足cm(h2o)n,因此,均属于糖类化合物 d. 1。右图装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.装置(Ⅰ)的离子交换膜只允许na+通过.已知电池充、放电的化学反应方程式为2na2s2+nabr3na2s4+3nabr.当闭合开关k时,x极附近溶液变红色.下列说法正确的是( )。


A.该装置工作时,b极发生还原反应
B.每生成1 mol O2,有44 g CO2被还原
C.该装置工作时,H+从a极区通过质子交换膜向b极区迁移
D.a电极的反应为:3CO2 + 18H++18e-= C3H8O+5H2O
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O CH3COOH+OH- K2=5.71×10-10△H2>0
CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是
A.对混合溶液进行微热,K1增大、K2减小

B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
下列实验操作中正确的是( )
A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴
下列关于金属的描述不正确的是
A.金属单质都有还原性
还原性 (1)与氧气等非金属反应 ①常温下,铝被空气中的氧气氧化,在表面生成一层致密的氧化物薄膜,阻止内部的金属继续跟氧气发生反应。原理:铝是极活泼的金属,因为表面致密氧化层而在空气中稳定,但会和很多其它氧化剂剧烈反应。不盘时密封保存用密封袋保存是个避免水分流失的办法,盘完后即密封,可最大限度避免开裂,如果表面过于干燥,可以用棉签沾水置于密封袋中,这点尤其适用于冬季干燥季节上蜡上油进行保护虽然我以前常提,紫檀珠子在请购时不能选择上蜡上油的,因为在挑选小叶紫檀串珠时,上蜡上油的珠子会遮盖珠子本身的问题,影响我们对珠子本身成色的判断。
C.铝箔在酒精灯上加热后熔化但不滴落,是因为表面形成的Al2O3层熔点很高
和可燃物混合点燃可以剧烈燃烧。(3)细铁丝(或铁粉)在氧气中能剧烈燃烧,铁钉(或铁制燃烧匙)在氧气中不能燃烧,反应物相同,但反应的速率不同.说明反应物的不同,反应的速率不同.。①与氧气的接触面积越大,燃烧越剧烈,如煤的燃烧经历了煤块→煤球→蜂窝煤的过程,蜂窝煤能使煤更充分燃烧的原因是与空气的接触面积增大。
我们公司已经拖欠4个月工资了