差分电荷密度图、电荷局域密度图(ELF)的画法及分析2
(2)放热型金属合金化对钒基贮氢材料性能影响的理论研究
在氢化物 VH2 中加入放热型金属 Mg、 Ca、 Ti、 Zr 以后,V51M12H64(M=Mg、 Ca、 Ti、 Zr)中最中心的 V和 H 之间电荷密度重叠性增强, 表明 V-H 之间的相互作用增加; 同时 M(M=Mg、 Ca、 Ti、 Zr)和 H之间的电荷密度重叠性较大, 表明 M-H(M=Mg、 Ca、 Ti、 Zr)之间也有较强的相互作用。所以, 放热型 金属合金化后,由于放热型金属本身 Mg、 Ca、 Ti、 Zr 可以吸氢, 同时又使 V-H 之间的相互作用增强, 氢 化物可以结合更多的氢,从而增加了贮氢量。但氢 化物不容易放出氢, 即吸放氢性能减弱。这与实验 结果及前面的结论一致。
(3)金属氢化物力学性能的第一性原理研究
当tio2表面和金属接触时,载流子重新分布,电子从费米能级较高的n型半导体转移到费米能级较低金属,直到它们的费米能级相同,形成肖特基势垒,肖特基势垒可作为俘获激发电子的有效陷阱,光生载流子被分离,从而抑制了电子和空穴的分离,提高光催化性能。因为电子有1/2的自旋,所以在外加磁场下能级二分.当外加具有与此能量差相等的频率电磁波时,便会引起能级间的跃迁.此现象称为电子自旋共振.缩写为esr.对相伴而产生的电磁波吸收称esr吸收.产生esr的条件为νo(mhz)=1.4·g·ho(高斯).式中νo为电磁波的频率,ho为外部磁场强度,g为g因子(g factor)或g值.一个分子中有多数电子,一般说每二个其自旋反相,因此互相抵消,净自旋常为0.但自由基有奇数的电子,存在着不成对的电子(其无与之相消的电子自旋).也有的分子虽然具有偶数的电子,但二个电子自旋同向,净自旋为一(例如氧分子).原子和离子也有具有净自旋的,cu2+、fe3+、和mn2+等常磁性离子即是.这些原子和分子为esr研究的对象.由于电子自旋与原子核的自旋相互作用,esr可具有几条线的结构,将此称为超微结构(hyperfine stru-cture).g因子及超微结构都有助于了解原子和分子的电子详细状态.也可鉴定自由基.另外,从esr吸收的强度可进行自由基等的定量.因为电子自旋的缓和依赖于原子及分子的旋转运动,所以通过对esr的线宽测定,可以了解原子及分子的动的状态.。 实际上, 当半导体表面和金属接触时, 载流子重新分布, 电子从费米能级较高的 n-半导体转移到费米能级较低的金属, 直到它们的费米能级相同, 从而形成肖特基势垒( schottky barrier) , 正因为肖特基势垒成为俘获激发电子的有效陷阱, 光生载流子被分离, 从而抑制了电子和空穴的复合。
如果电子被束缚在H原子的局域势场附近,则体系的稳定性变差(可由差分电荷密度图判断)。
当金属氢化物体系总的电子态密度在Fermi能级处出现奇异性的尖峰,或者电子被束缚在H原子的局域势场附近时,体系的稳定性差,有可能发生相变。
在低温下MH2(M=La,Nd,Gd,Tb,Y,Dy,Ho,Er,Lu,Sc)具有稳定的氟化钙结构,而MH2(M=Ti,Zr,Hf)的氟化钙结构不稳定。对于稳定的金属氢化物而言,抵抗体积形变、切应变和拉伸(或压缩)形变的能力由弱递增的顺序为LaH2,NdH2,GdH2,TbH2,YH2,DyH2,HoH2,ErH2,LuH2,ScH2。
(4) Hydride-Based Electride Material, LnH2 (Ln = La, Ce, orY)
Figure 3a shows the electron density map of LaH2 in the energyregion from −1.5 eV to EF.
Surprisingly, conduction electrons populate the cage site and showstrong anisotropic shape into the six neighboring La ions.
As seen in Figure 3b, the (110) plane obviously contains a largecontribution from La 5dz2 (eg, red part). Thus, we may regard LaH2Vas an inorganic electride in which the electrons reside in thecenter of the Ht8 cube. However, the electrides reported to dateare usually metal-rich compounds having cages surrounded bycations.2,3
Thus, we need to check the calculated electron distributioncarefully by estimation of the electron localization function (ELF)map in order to get information about unshared electrons.
3. in 1903,the wright brothers flew a plane for a brief 12 seconds at kitty hawk, north carolina. this was the beginning of the appearance of the plane. in 1911,glenn e.curiss designed and flew a successful plane. 1903年,莱特兄弟发明了第一架飞机,但只飞行了12秒。electrons in the lewis structure (electron dot diagram) are paired to show the bonding pair of electrons.。in order to form the compound pcl5, each chlorine atom must share one of its electrons with the central phosphorus atom, and the phosphorus atom must share 1 of its 5 electrons with each of the chlorine atoms:。
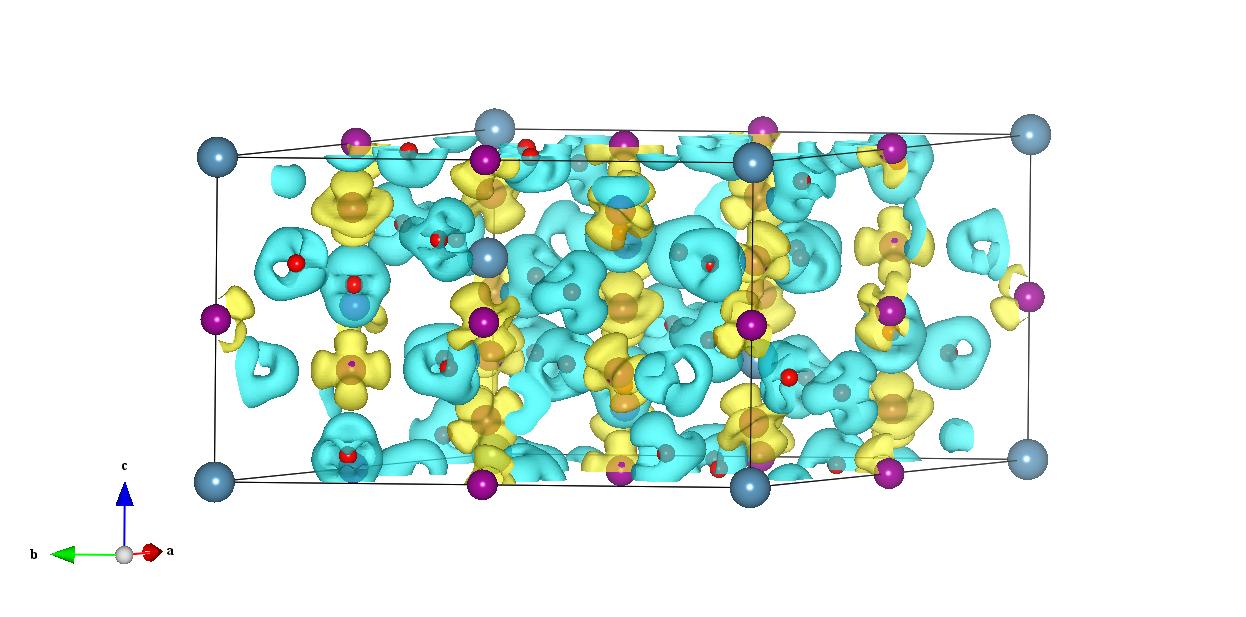
(5) 差分电荷密度图--透明钠:Transparent dense sodium
Difference charge density (e Å-3); crystal density minussuperposition of isolated atomic densities) plotted in the (110)plane at 320GPa (6.50Å-3 per atom)
Thus, the insulating state in Na-hP4 arises from the stronglocalization of valence electrons in the interstices of Na-hP4(Fig. 4c and Supplementary Fig. 6) enabled by p–dhybridization.
(5) Pressure-stabilized superconductive yttrium hydrides
Valence electrons localization was found between the twoneighbouring H2 atoms while absent between H1 and H2 atoms (Fig.2e). This indicates the presence of both molecular “H2” andmonoatomic H in tI10-YH4.
Despite the longer distance, covalent interaction between H atomsis clearly visible from the localized valence electrons between theH atoms (Fig. 2f).
The empirical consideration is support from quantitativecalculations of the difference of the electron density of tI10-YH4to that of a hypothetical structure consisting only Hsublattice.
It is clearly shown in Fig. 3(a,b), that there is no electrondensity (covalent bond) between the two H2 atoms in the pure Hstructure. However, when the Y atoms were present, localizedelectrons are found between two H2 atoms. Therefore, the chargetransfer from Y to H2 is responsible to the formation of molecular“H2” in YH4.
Similarly, the foramtion of “H6” hexagons in YH6 results from theaccommodation by H of excess electrons from Y atom (Fig.3c,d).
For comparison, a survey of molecular “H2” in most hydrogen-richcompounds only show a slightly elongated H-H bond length than puresolid H2. Examples are 0.87Å in GeH4 , 0.79Å in SnH4 , 0.84Å inSiH2(H2)2 , 0.76 Å in LiH2 and 0.8 Å in NaH9 .
网络问答:
(1) AA:: 如何在vaspview中画电荷密度等高线,图是我画出的电荷密度,想在上面添加等高线,求大能帮助
QQ:::
vesta:
Utilities->2D Data Display->Coutour
(2) AA::
怎么调节切片方向呢? 我切出来是这样的,调节ranges of fractionalcoordinates中参数都不管用,是不是调节其他参数啊
QQ:::
Utilities->2D Data Display->Coutours->Slice->hkl
然后还有distance from origin可以调 [距离原点的距离?]
QQ:::
用lev00来分析也很好。。。比较方便。
对的,你安装好lev00后,里面会有很多选项,包括可以任意指定切面。。
然后再用origin画。
(3) vaspview和vesta比较
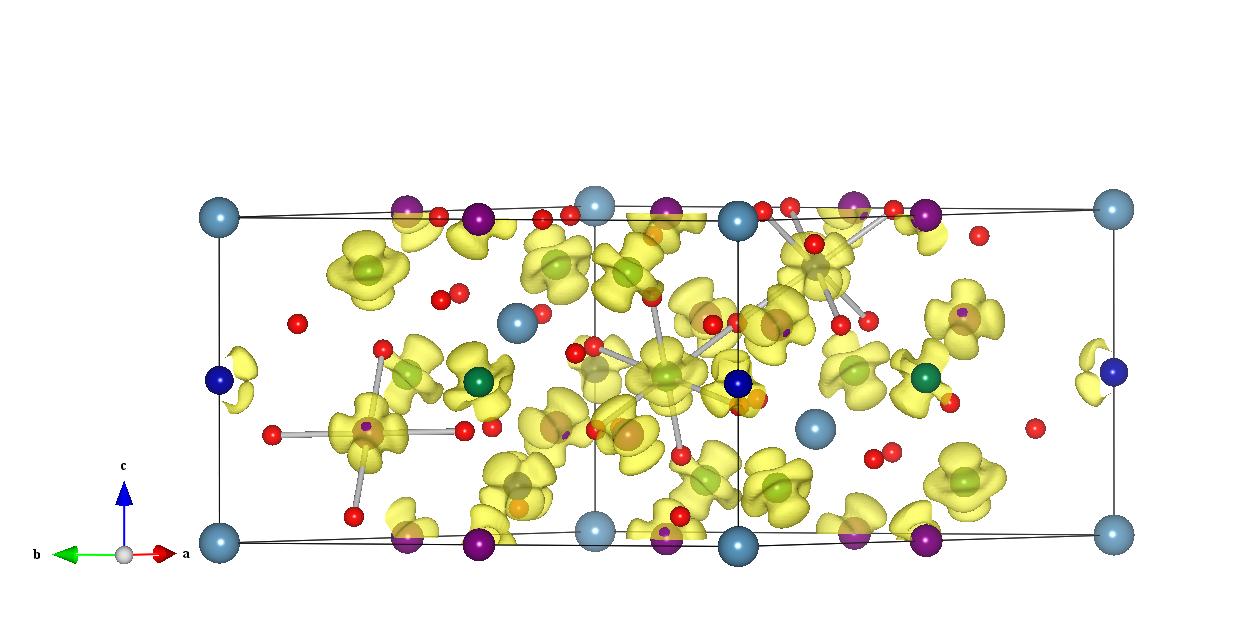
比较了一下,感觉还是vesta出来的图美观和操作方便些。vaspview里面的功能太少了。vesta切slice也很方便,不管z轴还是x轴还是任意方面的面都可以切。vesta中你的线消失是因为你切的面没落在原子上当然等高线就出不来了。
格式化的使用:先用光标选中文档中的某个带格式的“词”或者“段落”,然后单击选择“格式刷”,接着单击你想要将他们替换格式的“词”或“段落”,此时,他们的格式就会与开始选择的格式相同。不同晶界厚度时晶界原子数占总原子数百分比随晶粒直径变化关系 如a原子缺少三个近邻,b、c、d原子各缺少两个近邻,e原子缺少一个近邻,它们均处于不稳定状态, 近邻缺位越多越容易与其他原子结合,说明处于表面的原子(a、b、c、d和e)比处于内部的原子的配位有效明显的减少。6、软件窗口右边提供预览播放视频功能,选中想要预览的视频,点击播放按钮,就可以播放这个视频内容,遇到您喜欢的图片,可以直接点击 按钮,就可以将图片保存输出jpg格式,点击 按钮,可以打开保存的图片路径查看文件。
越王苟剑