高锰酸钾溶液化学式 2018年云浮市中考化学压轴试题【免费解析版】(12)
【专题】科学探究.
【分析】一氧化碳是一种污染空气的有毒气体,一氧化碳与人体血液中的血红蛋白结合,使人体缺氧而造成人体缺氧中毒;通常采用燃烧法处理尾气中的一氧化碳.
据高锰酸钾制取氧气的反应物、生成物写出方程式;据实验注意事项及氧气的密度解决.
提出猜想:可到“用带火星的木条伸入D中”,则可推测是检验氧气的,故可提出猜想 :CO2、O2.
:CO2、O2.
实验探究:为了验证自己的猜想,利用装置中的药品推测反应目的和现象,正确书写化学方程式;可以利用结论反推猜想③和实验现象.
【解答】解:碳及许多含碳化合物不 充分燃烧都要产生一氧化碳,一氧化碳是一种污染空气的有毒气体,它使人中毒的原因是:一氧化碳与人体血液中的血红蛋白结合,使人体缺氧;通常采用燃烧法处理尾气中的一氧化碳.某同学对一氧化碳与一定量的氧气反应后所得的气体成分进行了如下实验探究:
充分燃烧都要产生一氧化碳,一氧化碳是一种污染空气的有毒气体,它使人中毒的原因是:一氧化碳与人体血液中的血红蛋白结合,使人体缺氧;通常采用燃烧法处理尾气中的一氧化碳.某同学对一氧化碳与一定量的氧气反应后所得的气体成分进行了如下实验探究:
在猜想反应后的物质组成可能时,既要考虑生成物,又要考虑反应物的过量问题,若CO过量,则有CO和CO2,若O2过量则有CO2、O2,若恰好完全反应则只有生成物CO2.
高锰酸钾在加热的条件下可以分解产生二氧化锰、锰酸钾和氧气;化学方程式为:2KMnO4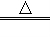 K2MnO4+MnO2+O2↑;因氧气的密度大于空气的密度,为得到较为纯净的氧气,氧气应从导管②进,空气从导管①排出.
K2MnO4+MnO2+O2↑;因氧气的密度大于空气的密度,为得到较为纯净的氧气,氧气应从导管②进,空气从导管①排出.
提出猜想:反应后气体的 组成可能是:①CO和CO2;②只有CO2;③CO2、O2.
组成可能是:①CO和CO2;②只有CO2;③CO2、O2.
实验探究:该同学为了验证自己的猜想,用下列装置进行实验:
①装置B中氢氧化钠溶液的作用是:①吸收二氧化碳(或除去二氧化碳).
②装置A中出现的现象是:澄清石灰水变浑浊,用带火星的木条伸入D中出现的现象是:木条复燃.
实验结论:通过实验验证,猜想③成立.
故答案为:一氧化碳与人体血液中的血红蛋白结合,使人体缺氧;2KMnO4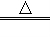 K2MnO4+MnO2+O2↑;②;
K2MnO4+MnO2+O2↑;②;
提出猜想:③CO2、O2
实验探究:①吸收二氧化碳(或除去二氧化碳)
②木条复燃.
【点评】掌握二氧化碳与一氧化碳的化学性质;了解猜想与实验探究的方法;掌握常用气体的检验和除杂的方法.
五、计算题
23.如图是诺氟沙星胶囊的说明书,某患者遵医嘱,每次服用诺氟沙星胶囊400mg,一段时间后病情有了好转,(诺氟沙星的化学式为C16H18FN3O3),请回答以下问题:
(1)诺氟沙星分子中碳、氢的原子个数比为8:9;(最简整数比)
(2)诺氟沙星中氮元素的质量分数是13.2%;(精确到0.1%)
(3)从组成上可知诺氟沙星属于化合物(填“单质”或“化合物”);患者一个疗程共服用了80粒诺氟沙星胶囊.
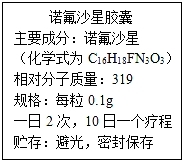
【考点】标签上标示的物质成分及其含量;单质和化合物的判别;化学式的书写及意义;元素的质量分数计算.
【专题】标签图示型.
【分析】(1)根据诺氟沙星的化学式进行分析解答.
(2)根据化合物中元素的质量分数= ×100%,进行分析解答.
×100%,进行分析解答.
(3)根据诺氟沙星的组成分析类别,根据用量计算诺氟沙星胶囊的总量.
【解答】解:(1)1个诺氟沙星分子中含有16个碳原子、18个氢原子,则诺氟沙星分子中碳、氢的原子个数比为16:18=8:9.
(2)诺氟沙星中氮元素的质量分数是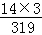 100%≈13.2%.
100%≈13.2%.
(3)诺氟沙星是由不同元素组成的,属于化合物;由题意,某患者遵医嘱,每次服用诺氟沙星胶囊400mg=0.4g,每粒0.1g,则每次应服用0.4g÷0.1g=4粒;每日2次,十日为一个疗程,则患者一个疗程共服用了诺氟沙星胶囊的粒数为4粒×2×10=80.
故答案为:(1)8:9;(2)13.2%;(3)化合物,80.
【点评】本题难度不大,考查同学们结合标签新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.
再见