高中化学喷泉实验 【化学】高中化学必修一知识点总结(7)
二、氯及其化合物
氯原子结构示意图为
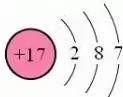
,氯元素位于元素周期表中第三周期第ⅦA族,氯原子最外电子层上有7个电子,在化学反应中很容易得到1个电子形成
Cl-,化学性质活泼,在自然界中没游离态的氯,氯只以化合态存在(主要以氯化物和氯酸盐)。
1、氯气(Cl2):
(1)物理性质:黄绿色有刺激性气味有毒的气体,密度比空气大,易液化成液氯,易溶于水。(氯气收集方法—向上排空气法或者排饱和食盐水;液氯为纯净物)
(2)化学性质:氯气化学性质非常活泼,很容易得到电子,作强氧化剂,能与金属、非金属、水以及碱反应。
①与金属反应(将金属氧化成最高正价)
Na+Cl2===点燃2NaCl
Cu+Cl2===点燃CuCl2
2Fe+3Cl2===点燃2FeCl3(氯气与金属铁反应只生成FeCl3,而不生成FeCl2。)
(思考:怎样制备FeCl2?Fe+2HCl=FeCl2+H2↑,铁跟盐酸反应生成FeCl2,而铁跟氯气反应生成FeCl3,这说明Cl2的氧化性强于盐酸,是强氧化剂。)
②与非金属反应
Cl2+H2 ===点燃 2HCl(氢气在氯气中燃烧现象:安静地燃烧,发出苍白色火焰)
将H2和Cl2混合后在点燃或光照条件下发生爆炸。
燃烧:所有发光发热的剧烈化学反应都叫做燃烧,不一定要有氧气参加。
③Cl2与水反应
Cl2+H2O=HCl+HClO
离子方程式:Cl2+H2O=H++Cl—+HClO
将氯气溶于水得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的)。
氯水的性质取决于其组成的微粒:
(1)强氧化性:Cl2是新制氯水的主要成分,实验室常用氯水代替氯气,如氯水中的氯气能与KI,KBr、FeCl2、SO2、Na2SO3等物质反应。
(2)漂白、消毒性:氯水中的Cl2和HClO均有强氧化性,一般在应用其漂白和消毒时,应考虑HClO,HClO的强氧化性将有色物质氧化成无色物质,不可逆。
(3)酸性:氯水中含有HCl和HClO,故可被NaOH中和,盐酸还可与NaHCO3,CaCO3等反应。
(4)不稳定性:HClO不稳定光照易分解。,因此久置氯水(浅黄绿色)会变成稀盐酸(无色)失去漂白性。
(5)沉淀反应:加入AgNO3溶液有白色沉淀生成(氯水中有Cl-)。自来水也用氯水杀菌消毒,所以用自来水配制以下溶液如KI、 KBr、FeCl2、Na2SO3、Na2CO3、NaHCO3、AgNO3、NaOH等溶液会变质。
④Cl2与碱液反应:
与NaOH反应:Cl2+2NaOH=NaCl+NaClO+H2O(Cl2+2OH-=Cl-+ClO-+H2O)
与Ca(OH)2溶液反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
此反应用来制漂白粉,漂白粉的主要成分为Ca(ClO)2和CaCl2,有效成分为Ca(ClO)2。
漂白粉之所以具有漂白性,原因是:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO生成的HClO具有漂白性;同样,氯水也具有漂白性,因为氯水含HClO;NaClO同样具有漂白性,发生反应2NaClO+CO2+H2O==Na2CO3+2HClO;
干燥的氯气不能使红纸褪色,因为不能生成HClO,湿的氯气能使红纸褪色,因为氯气发生下列反应Cl2+H2O=HCl+HClO。
漂白粉久置空气会失效(涉及两个反应):Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,,漂白粉变质会有CaCO3存在,外观上会结块,久置空气中的漂白粉加入浓盐酸会有CO2气体生成,含CO2和HCl杂质气体。
都是从资本市场中成为顶级的富豪的